
【药物制剂】开启药品“私人订制”时代——盘点5大3D打印制剂技术(下)
上一篇文章,我们主要介绍了选择性激光烧结(SLS)、光固化成型(SLA)以及熔融沉积成型(FDM)三种3D打印制剂技术,本文我们继续来学习半固体挤出成型(SSE)、喷墨成型打印(IJP)这两种技术,最后总结一下3D打印技术的应用优势以及劣势。
2021-08-26
【药物制剂】你还在学习压片的时候,有人已经开始3D打印药了——盘点5大3D打印制剂技术(上)
自从2016年FDA批准首个3D打印药物Spritam上市以来,3D打印技术引起了越来越多的制药人的关注。3D打印技术是一种将材料逐层打印的制备技术。目前应用于制药行业的3D打印技术有选择性激光烧结(SLS)、光固化成型(SLA)、熔融沉积成型(FD...
2021-08-25
【增容课堂(6·完结)】制剂微环境酸碱度调节技术
微环境酸碱度的调节可以通过在制剂中加入酸性或碱性的酸碱度调节剂来实现。调节完制剂微环境的酸碱度后,药物溶出度的改善程度会受到一些因素的影响,如药物本身的理化性质、酸碱度调节剂及制剂辅料的类型、剂型以及制备工艺等,这些都会对药物的溶出度有一定的影响。
2021-07-15
【增溶课堂(5)】亲脂性难溶药物的克星——手把手教你设计自乳化给药系统
本文是四月老师“增容课堂”系列的第五篇文章,围绕自乳化给药系统进行了深入讲解,研究制剂技术的小伙伴一定不要错过!
2021-07-13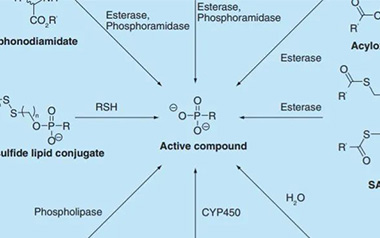
【制剂增溶课堂(4)】盘点前体药物技术的分类及应用
如今,前药技术已成为改善药物水溶性以及脂溶性的重要方法之一。选择合适的母体药物和基团(如酯、酰胺、氨基酸酯和磷酸盐),可以决定前药的理化性质、毒性以及生物利用度,这一点尤为关键。
2021-07-12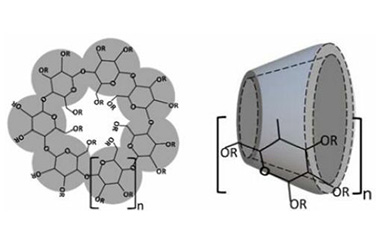
【增溶技术课堂(3)】环糊精包合物
今天我们就接着前面的文章,进一步来学习一下环糊精包合物在药物增溶中的作用以及该技术在药物研发中的实际应用案例。
2021-07-09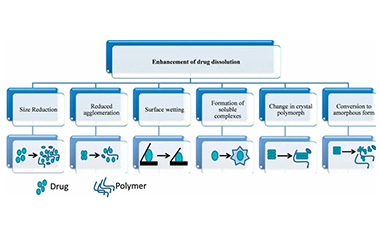
【增溶课堂(2)】一文详解固体分散体增溶原理、制备技术、载体选择
在我们药物研发过程中,不可避免的会遇到难溶性的药物溶解度差的问题,希望当遇到这个问题而没有头绪时,小编的一篇文章可以为大家提供一点点思路。
2021-07-06
【增溶技术课堂】盘点10大药物增溶策略,制剂必看!
药物的溶解度是影响口服固体制剂吸收的重要因素。我们都知道,固体口服制剂只有药物先溶解,才可以进行后续的吸收。而药物溶解性差会产生不良的ADME过程,会导致口服生物利用度低、化学稳定性差、处方优化困难等问题。
2021-07-05
【PPT分享】注射剂一致性评价药学研究技术要求——国家局高级研修学院特聘教授余立
6月3日上午,国家局高级研修学院特聘专家余立教授在药仁汇2021北方(北京)峰会暨首届中国国际仿制药发展大会政策法规主论坛为大家带来了一场40分钟的演讲,分享注射剂一致性评价药学研究技术要求。
2021-06-08
【药物制剂】圆盘法、颗粒法……药物固有溶出测定法全解
本文将重点对转盘法、定盘法、粗颗粒法及悬浮颗粒法的试验方法、影响因素及应用情况进行介绍。
2021-05-22






