
【行业新闻】CDE《关于暂停药品注册受理现场办理的通知》
为保障新修订《药品注册管理办法》顺利实施,按照《国家药监局关于药品注册相关系统升级改造的公告》要求,2020年6月28日至6月30日,国家药监局将暂停使用现有药品注册相关系统,相应的药品注册受理业务也将暂停。现就受理有关事宜通知如下:
2020-08-10
【药物分析】最新的药物杂质研究方法,一定要收藏!
本文提出了杂质来源分析的重要作用,同时重点探讨了杂质研究过程中分析技术的发展,尤其在结构鉴定中质谱技术的发展,与此同时,根据国外毒性杂质研究的指导原则,明确了杂质毒性研究的方法。
2020-08-10
【药物分析】如何科学、客观地制订溶出度试验质量标准
溶出度试验在评价口服固体制剂内在品质方面发挥重要作用,本篇将详尽阐述如何制订溶出度试验质量标准。
2020-08-06
【药物分析】固体口服制剂的“灵魂”——溶出度
随着目前对仿制药品生物等效性的日益关注,溶出度实验也被赋予了优化处方和制备工艺、保证处方工艺等变更后产品质量的一致性等更多的功能。本文对利用溶出度试验评价/预测固体口服制剂生物等效性的研究进展进行综述。
2020-08-06
【药物制剂】喷雾干燥固体分散技术如何增加药物溶解性?
笔者以“喷雾干燥” “固体分散” “增溶” “Spray drying” “Solid dis-persion”“ Solubility enhancement”等为关键词,组合查询 2005-2016 年在 PubMed、Elsevier Scie...
2020-08-05
【药物分析】浅谈HPLC法测定有关物质时已知杂质的计算方法
HPLC法测定有关物质中已知杂质的测定方法很多, 计算方法也相应很多,每种计算方法都有不同的意义及其优缺点, 下面参考国内外药品标准和相关期刊文献, 结合在药品检验中的实际工作, 对这些计算方法作一简单探讨, 以期为药品质量标准的建立或进行相关研究时...
2020-08-05
【行业新闻】CDE发布《化学仿制药参比制剂遴选申请资料要求(征求意见稿)》
为更好地服务申请人,进一步提高参比制剂遴选工作的质量和效率,结合国家局《关于发布化学仿制药参比制剂遴选与确定程序的公告》(2019年第25号)的实施情况,我中心组织起草了《化学仿制药参比制剂遴选申请资料(征求意见稿)》,现在中心网站予以公示。欢迎各界...
2020-08-05
【药物制剂】带你认识药用辅料界的“F4”
本文以乳糖、纤维素衍生物、磷酸盐、甘露醇为例从经济性与技术性评价两方面,分析了其主流固体制剂填充与黏合剂的特点,以便为口服固体制剂中药用辅料的筛选提供科学依据。
2020-08-03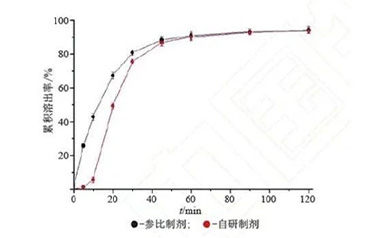
【药物分析】为什么口服固体制剂溶出方法必须具有体内外相关性?
本文通过查阅国内外药检机构关于建立和验证药物溶出方法的最新指导原则和相关文献, 结合研究经验和认识, 综述了普通口服固体制剂溶出方法建立和溶出度标准制定的常见问题及研究进展。
2020-08-03
【药物分析】把握好杂质研究与控制的“度”
秉承临床使用制剂、而非原料药的原则,针对仿制品中特有杂质,无论原料药还是制剂,均以制剂限度予以要求,便可极大程度地减少在原料药开发上的资金投入与时间成本。此处,也恳请CDE 老师们思忖定夺,从而引导众人更为客观理性地把握好杂质研究与控制的“度”。
2020-07-31






