【药物制剂】实战解析!一文了解剂型改良药物研发中的“突发情况”
剂型改良是新药研发的重要途径之一,按照我国的注册分类管理规定,这类药一般属于注册分类2类(改良型新药)。在中国国家药品监督管理局(NMPA)药品审评中心(CDE)官网上公布的1942个临床试验默示许可批号中,有203个批号的注册分类属于2类,其中大多...
2021-03-10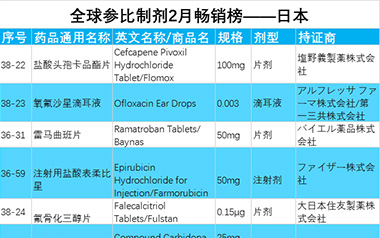
【排行榜】日本、欧盟、美国,2月,这些参比制剂最火爆!
2月日本,欧盟,美国热门的参比制剂
2021-03-09
【药物分析】处方工艺?质量研究?纳米注射剂一致性评价要点全解析
我国对这类特殊注射剂的研发水平尚处在起步阶段,且缺少相应的指导原则,导致其仿制药的审评监管面临着极大的挑战。为确保纳米注射剂原研药替代产品的安全、有效和质量可控,明确纳米注射剂仿制药的评价体系和技术要求尤为重要。
2021-03-07
【药物制剂】生物类似药与原研的“相似性”证明有多难?CDE老师告诉你答案!
细胞基质和生产工艺的变化都可能影响终产品蛋白的糖基化修饰的组成和结构。因此,研发单位需要对不同研发阶段的蛋白药物进行全面深入的表征,保证生产工艺的一致性、产品的安全性、生物类似药和原研药的可比性。本文将以IgG类单克隆抗体为例,介绍蛋白类药物审评工作...
2021-03-06
【药物分析】氯化钾缓释片生物等效性研究全解析
氯化钾在临床上用于治疗和预防低钾血症。由于钾为内源性物质,是正常人体必需饮食成分,其生物等效性研究存在较大特殊性,在一致性评价和仿制药申报工作中,氯化钾缓释片的生物等效性研究申报资料存在各种各样的问题,本文拟分析这些问题,并提出相关建议。本文内容仅从...
2021-02-28
【CDE专家一对一】药研好难,我要怎么继续?
今天,我们再一次为大家整理了一些精彩的CDE老师一对一解答,希望能帮助到您^_^
2021-02-26
【药物制剂】多规格口服固体制剂仿制药生物豁免的药学考虑
笔者经调研国内外相关指南,重点从药学角度(如处方和体外溶出相似性)分析讨论多规格固体制剂规格间生物豁免的要求(包括常释及调释制剂),代表个人观点和审评体会,希望对仿制药及已上市化学药品仿制药的一致性评价工作提供帮助。
2021-02-25
【药研杂记】每日科普!制药工业过程中的有机废气及其治理
制药工业在生产过程中会产生废气,其中原料药合成产生的废气与化工过程的废气相似。药物制剂过程产生的废气排放量大,浓度低,同时,因药物的毒性和致敏性等,其废气处理与一般工业废气的处理不尽相同。
2021-02-23
【药物制剂】干货!透皮贴剂仿制药的技术要求及研发要点
本文就国内外上市透皮贴剂、欧美关于透皮贴剂仿制药的技术要求和实践等进行综述,探讨我国透皮贴剂存在的问题并提出建议,为我国透皮贴剂仿制药的研发和监管提供参考。
2021-02-21
【药物制剂】临床试验统计学设计让人头大?不慌,CDE老师有妙招
本文将通过实际的案例对常见的统计学设计咨询问题进行总结和分析解答,希望为同类咨询问题的解决提供参考,指导药物临床试验的开展,加快药物研发的进程;同时还希望可以减少同类问题的咨询申请,节约审评的资源。
2021-02-19






