
【药物分析】这6种液相色谱检测器,分析研究员都知道!
检测器的作用是将柱流出物中样品组成和含量的变化转化为可供检测的信号,常用检测器有紫外吸收、荧光、示差折光、化学发光等。
2021-09-14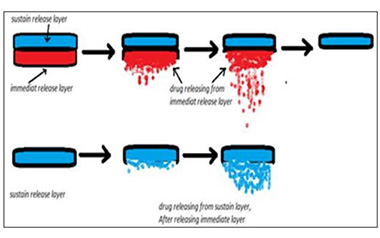
【药物制剂】关于双层片,你需要知道的6个问题!
目前,在治疗疾病的制剂中,口服速释制剂的需求量较大,这也是最传统的治疗方式。但是为了维持有效的药物浓度,口服速释制剂往往需要每天多次服用,导致了患者的依从性较差。为了避免这一问题,研究人员开发了能够控制药物在作用部位的释放速度的技术,双层片技术就是其...
2021-09-01
【药物制剂】万万没想到,辅料选择的学问竟然这么深!
辅料即处方中除主要活性成分以外的一切物料的总称,例如粘合剂、崩解剂、润滑剂、填充剂等。口服固体制剂的辅料选择,受到其原料药理化性质、制剂制备工艺以及辅料价格等因素的影响。下面我们一起来看看固体口服制剂中常用到的辅料吧。
2021-08-31
【药物制剂】原研厂家死守的处方工艺信息,如何用逆向工程轻松破解?
为了维护商业地位,有些关键质量属性在原研的申报资料或说明书中并没有介绍,或者被遮挡住了,该怎么办?没关系,今天我们就来学习一下如何运用逆向工程技术获得我们想要的处方工艺信息。
2021-08-30
【药物制剂】如何确保成品剂量均一性?5分钟,盘点4大制粒技术!
制粒是通过凝聚技术,使颗粒增大,从而有效改善物料流动性的的一种技术。目前有多种成熟的制粒方法,大体上分为湿法制粒与干法制粒,我们需要根据自己项目的实际情况选择合适的制粒方式。
2021-08-27
【药物制剂】开启药品“私人订制”时代——盘点5大3D打印制剂技术(下)
上一篇文章,我们主要介绍了选择性激光烧结(SLS)、光固化成型(SLA)以及熔融沉积成型(FDM)三种3D打印制剂技术,本文我们继续来学习半固体挤出成型(SSE)、喷墨成型打印(IJP)这两种技术,最后总结一下3D打印技术的应用优势以及劣势。
2021-08-26
【药物制剂】你还在学习压片的时候,有人已经开始3D打印药了——盘点5大3D打印制剂技术(上)
自从2016年FDA批准首个3D打印药物Spritam上市以来,3D打印技术引起了越来越多的制药人的关注。3D打印技术是一种将材料逐层打印的制备技术。目前应用于制药行业的3D打印技术有选择性激光烧结(SLS)、光固化成型(SLA)、熔融沉积成型(FD...
2021-08-25
【药物分析】液相色谱仪操作错误示范完整版
做分析试验时哪些(骚)操作不能做?哪些懒不能偷?希望看完此文,大家都能用好液相色谱仪,未来我们还是好朋友!
2021-08-19
【公司新闻】对话资本,展望未来,铭研医药CEO何小炳出席“赢在丰台”投资路演活动
7月20日下午,由北京市丰台区发展投资有限公司与中国医药保健品进出口商会投资委员会共同举办的“赢在丰台”医药健康项目投资路演活动在中都科技大厦四层路演厅成功举办。新动能基金、中信医疗基金、中金公司等十余家投资机构委派代表出席活动。北京铭研医药研究有限...
2021-07-21
【药研新闻】博士后头顶火苗、衣不蔽体冲出实验室——这些操作,一定不要做!
一位在化学领域工作多年的前辈,将向我们分享他亲身经历的那些惊心动魄的安全事故。这些文字读起来轻松幽默,但教训深刻,希望这些事永远不会发生在大家身上!
2021-07-20






