
为方便临床试验过程中申请人电子递交 “研发期间安全性更新报告”、“非个例的潜在严重安全性风险信息报告”及“其他研发期间安全性相关报告”(如,重要已识别风险的报告,采取紧急安全性措施的报告,及申请人判断不需按照补充申请申报的与安全性相关的方案变更等),中心在“申请人之窗”开通了“研发期间安全性相关报告递交”栏目。
电子递交栏目开通后,中心不再接收纸质提交的上述报告。《药物临床试验期间安全性数据快速报告标准和程序》中要求的其它非个例的潜在严重安全性风险信息的快速报告不再通过lcqjywjj@cde.org.cn接收。
特此通知
药品审评中心
2019年4月26日
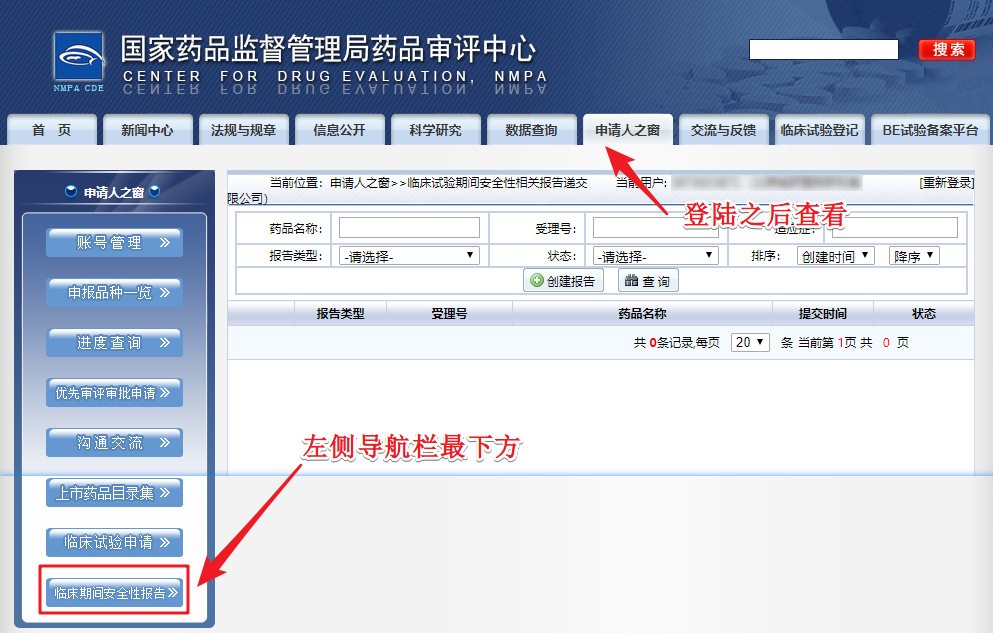
附:新增栏目位置示意图
声明:药研江湖对所有公众号产生内容保持严谨、中立的态度。文章仅供交流学习使用。如遇到内容有误,请与我们联系进行讨论和修改。(010-65104668)








