2019年5月,美国FDA的 CDER发布了《抗肿瘤药物生殖毒性检测和说明书建议指导原则》(Oncology Pharmaceuticals: Reproductive Toxicity Testing and Labeling Recommendations)正式稿,该指导原则根据ICH S9"抗癌药物非临床评价"(2010年3月发布)和ICH S9问答(2018年6月发布)指南的基本原则,细化了抗肿瘤药的生殖毒性试验要求,包括不同类型和特殊人群的抗肿瘤药的胚胎-胎仔发育(EFD)毒性试验评价,使用已有信息评估进行专门的胚胎-胎仔发育(EFD)试验的必要性,并明确了生育力和围产期发育毒性评估或试验的要求。此外,从保护受试者风险的角度,为尽量减少发育中的胚胎或胎儿风险,明确了说明书中对男性和女性患者避孕时间的建议。此指导原则对于抗肿瘤药物生殖毒性评价具有参考意义。现翻译整理该指导原则,供研发者和评价者参考。
提示:关注公众号:药研江湖,后台回复“ICH S9”,获取CDE翻译的中文版《S9:抗肿瘤药物非临床评价指导原则》指导原则。回复“FDA 抗肿瘤药”,获取下载好的《抗肿瘤药物生殖毒性检测和说明书建议指导原则》。
该指导原则的目的是帮助申请人评估抗肿瘤药物生殖毒性[主要是胚胎-胎仔发育(EFD)影响],并为产品说明书在停止治疗后的避孕时间提供建议,以尽量减少对发育中的胚胎/胎儿的潜在风险。该指导原则旨在促进抗肿瘤药的开发,同时根据3R(减少、优化、替代)原则避免不必要的动物使用。指导原则将对以下方面进行讨论:
● 不同类型药物的EFD毒性评价
● 拟用于特殊人群药物的EFD毒性评价
● 使用已有信息,如遗传毒性和一般毒理学试验的结果、靶标生物学的认识、转基因动物的已有数据,评估进行专门的EFD试验的必要性
● 说明书中为尽量减少发育中的胚胎或胎儿的风险,对男性和女性患者避孕时间的建议(说明书中“女性和男性生殖潜在影响”小节)
该指导原则为拟治疗癌症患者的药物开发提供信息。患者人群与ICH S9指导原则“抗癌药物非临床评价”(2010年3月)相同,并在ICH S9问答(2018年6月)中进一步明确。虽然为支持晚期恶性肿瘤患者的上市申请,需要对EFD毒性进行评估,但通常不需要进行生育力试验和围产期发育(PPND)毒性试验。但是,对于用于某些辅助药物(如乳腺癌)或新辅助适应症的药物,根据具体情况可能进行生育力和PPND评估,并在批准上市后提交结果。因此,本指南还讨论了生育力和PPND试验。对于向监管机构提交试验结果的时间的其他信息,请参考ICH S9和ICH S9问答。
该指导原则不涉及放射性药物、细胞和基因治疗产品、癌症疫苗、生物类似物或可互换药物、仿制药的生殖毒性风险。指导原则不涉及全身暴露或剂量的安全范围。对于许多抗肿瘤药物,特别是小分子药物,其安全范围没有确定[即动物在暴露量或剂量与患者中的相当或低于患者时,在动物中观察到胚胎-胎仔毒性[国家毒理学计划(National Toxicology Program)2013年]。指导原则不涉及临床试验中的胚胎-胎儿的潜在风险,因为当临床试验中纳入有生育可能妇女时,采用妊娠检测和使用高效的避孕方法通常足以将胚胎或胎儿意外暴露的风险降至最低。
该指导原则是ICH S9和ICH S9问答的补充。ICH S5(R3)“人用药物生殖毒性检测”(草案)(2017年11月)和ICH S6(R1)“生物制品的临床前评价”(2012年5月)阐述了生殖毒性评价的具体试验设计。通常,当证据权重分析(WOE)显示明显的不良生殖影响时,可能不需要额外的生殖毒性试验。该指导原则提供了ICH S9中未描述的WOE法的一些例子(见第II A节“一般建议”)。由于抗肿瘤药物的发育毒性潜在风险,必须在避孕时间上采取一致的方法,以将发育中的胚胎或胎儿意外暴露于这些药物的风险降至最低。
提示:提示:关注公众号:药研江湖,后台回复“ICH S5 S6”,获取CDE翻译的中文版。
对于该指导原则,术语“药物”指小分子、生物制品和相关的化合物如偶联产品。术语“致畸性”(teratogenicity)是指引起对正常胚胎-胎仔发育的干扰从而可能导致畸形的事件。对于某些类型药物(例如免疫抗肿瘤药)的胚胎-胎仔致死性可能是对胎仔的直接作用之外的机制所致,如无明显致畸性的免疫排斥。因此,该指导原则中的“胚胎-胎仔致死性(embryo-fetal lethality)”表示胚胎或胎仔的死亡,而不论其死亡原因。
一般情况下,EFD毒性试验应遵循ICH S9和ICH S9问答中的建议。显示具有生殖毒性潜力的WOE法可能消除进行专门的EFD试验的必要性,并可应用于第II节 B~F讨论的药物。对于小分子,如果需要进行EFD试验,EFD试验通常在两个动物种属中进行;当在一个种属的试验中致畸性或胚胎-胎仔致死性结果呈阳性时,通常不需要进行第二个种属的试验。对于生物制品,当需要EFD试验时,通常在一个药理学相关动物种属中进行试验就足矣。通常,如果剂量范围探索试验(包括非GLP条件下的试验)显示胚胎-胎仔致死性或致畸性的明确证据,则没有必要进行确定性试验。
WOE方法可包括以下信息:
● 人类生殖结果,如当一个药物属于对生殖影响具有大量的公开信息的药物类别时。
● 来自转基因动物或药理学抑制模型中的生殖发现,当合适时。
● 来自替代分子的信息,当替代分子可获得且动物种属中的靶标生物学与人类相关时。
● 基于文献的对人类或动物种属靶标生物学的评估,其可以描述以下内容:
- 分子靶标在胚胎-胎仔发育过程中的表达和作用。
- 任何其他相关资料,如靶标在胎盘发育、胎盘转移、母体耐受等方面的作用。
● 替代试验的使用,例如符合目的的体外或离体,或非哺乳动物体内试验。
监管机构支持3R原则,即在可行的情况下减少、优化和替代试验中所用动物。如果申请人希望使用上文未描述的其他试验方法或策略,可与监管机构协商。监管机构将考虑是否可以使用该替代方法或策略来代替动物试验。
一般毒理学试验显示靶向于快速分裂细胞,且具有遗传毒性(如Ames试验结果为阳性,或 Ames试验结果为阴性但两种哺乳动物遗传毒性试验结果为阳性)的药物,被认为具有致畸性和/或胚胎或胎仔致死性。这种情况下,FDA认为EFD试验不是必须的。
对于生物制品,当WOE不足以鉴定EFD危险时,通常,在一个药理学相关动物种属中进行EFD试验就足矣。当药物无药理学相关动物种属,并且没有相关的替代药物时,通常不需要进行EFD试验。
对于包含有生物制品部分和小分子部分的偶联药物,EFD试验的设计取决于多种因素,如生物制品部分对靶点的结合、小分子释放的可能性、小分子的性质(如作用机制)、对毒性来源的认识(生物制品部分、小分子部分)。例如,对于抗体偶联(ADC)药物,当小分子部分是细胞毒类药物(遗传毒性和靶向于快速分裂细胞)时,不需要进行EFD试验(见Ⅱ.B遗传毒性药物)。如果一个ADC药物需要进行EFD试验(如WOE不充分),当偶联药物的毒性与小分子相关且抗体不与动物种属中的靶点结合时,申请人可进行单独的小分子(或小分子连接子)试验。
当联合用药中的药物不作为单药治疗且联合用药产品的毒理学特性预期将与每个单药不同(如,当联合用药产品可能生成一个新的代谢产物或导致之前已确定的代谢产物水平明显增加)时,应使用联合用药产品进行EFD试验。在这种情况下,每种药物单独的EFD试验可提供不完整的EFD评估。如果联合用药产品中有一种(或多种)药物具有EFD资料或WOE评估,表明具有致畸性和/或胚胎-胎仔致死性,通常不需要进行联合用药产品的额外的EFD试验。当联合用药中的药物也将用于单药治疗时,则应单独对每种药物进行EFD评估或试验。
通常制成脂质体制剂是为了改变活性药物成分(API)的药代动力学参数(如增加API的暴露量或改变API的分布)。当脂质体产品含有靶向快速分裂细胞的遗传毒性药物(见II.B“遗传毒性药物”),或当WOE显示具有致畸性或胚胎-胎仔致死性时,不需要进行EFD试验。此外,如果以前采用未包封药物进行了EFD试验,且显示有致畸性和/或胚胎-胎仔致死性,通常不需要再进行单独的脂质体制剂的EFD试验。但是,当WOE不充分和API以前未显示具有致畸性或胚胎-胎仔致死性时,申请人需要进行脂质体制剂的EFD试验,因为脂质体可改变药代参数和脂质体中所用新成分可能会影响胚胎-胎仔发育。
拟用于治疗晚期癌症患者的药物不需要进行生育力和早期胚胎发育毒性试验。申请人应利用关于药物对生殖器官影响的一般毒理学试验的信息,来作为评估生育力损害的基础。不需要在性成熟的非人灵长类动物(NHP)中进行一般毒理学试验以评价生育力
当适应症不是晚期肿瘤时,根据具体情况可能需要进行单独的生育力试验。当NHP是唯一相关的种属时,申请人可以在重复给药毒性试验中评估生育力影响,而不需要进行单独的生育力试验。如果基于总体数据(如对靶标生物学的认识和/或一般毒理学试验的结果)确定了潜在的生育力风险,不需要进行单独的生育力试验,或者根据患者人群,不需要进行生育力试验。例如,如果一种拟用于治疗早期前列腺癌的药物耗竭了雄性激素,那么就没有必要进行雄性生育力试验(因为该药物被认为可以降低生育力),也没有必要进行雌性生育力试验(因为该药物仅用于男性)。
拟用于治疗晚期癌症患者的药物通常不需要进行围产期发育(PPND)毒性试验。当用于非晚期癌症时,根据具体情况可能需要进行PPND试验。以下案例描述了当治疗非晚期癌症患者时但不需要进行PPND试验,因为试验结果为预期的或试验不会提供有用的信息:
● 致畸性药物通常不需要进行围产期毒性试验。这种药物预期会对子代生长和发育产生不良影响。
● 当一个药物引起胚胎-胎仔死亡时,申请人应考虑是否有足够数量的子代来评价对发育的影响。对于引起胚胎-胎仔高死亡率的药物,通常不需要进行PPND试验。
拟仅用于男性的药物(如前列腺癌)不需要进行EFD试验。任何关于精液转移所致的对发育中胚胎或胎儿的风险的担忧可以通过避孕的持续时间来解决(见第Ⅵ节“对避孕的建议”)。避孕信息需要在说明书的“男性和女性生殖潜在影响”小节予以注明。对于拟用于这种患者人群的药物不需要进行PPND试验。如果药物的适应症非晚期癌症(例如早期前列腺癌),并且基于一般毒理学试验或靶标生物学的结果对生育力不能充分评估(见第Ⅲ节“生育力评估”),申请人应考虑进行雄性动物生育力试验。
拟仅用于绝经后妇女的抗肿瘤药物不需要进行生殖毒性试验。通常, “绝经”定义为无其他医学原因而长期停经超过12个月,或根据其它因素定义,如血清促卵泡激素(FSH)水平和双侧卵巢切除术。申请人应与FDA的相关临床审评部门讨论用于确定绝经状态的标准。
对于晚期癌症用药,当适应症包括已进入青春期患者时,申请人应提供EFD试验或评估(如果合适);这通常包括女性和男性的生殖潜力的评估,包括青少年(12~17岁)。有关EFD试验的更多信息,请参见第Ⅱ节“ 胚胎-胎仔发育毒性评估”。如果治疗可治愈或者显著提高生存,申请人应该考虑完整的生殖毒性试验组合(即生育力、EFD和PPND),除非该药属于该指导原则第Ⅱ节至第Ⅴ节所述的可能不需要进行生殖毒性试验的情况。

当确定存在药物介导的生殖毒性风险之后,提交的说明书中应包括关于停止治疗后避孕时间的建议。当建议是必需时(见表1和表2),说明书的“女性和男性生殖潜在影响”小节应包括避孕时间,以尽量减少接受抗肿瘤药物治疗的女性患者和接受抗肿瘤药物治疗的男性患者的女性伴侣的EFD风险。
以下说明书建议的科学基础基于多种因素,包括对配子发生和此过程中的性别差异的认识。Ⅵ.A“遗传毒性药物”和Ⅵ.B“非遗传毒性药物”部分提供了这些理由。这些说明书建议基于生殖毒性(比如致畸性和胚胎-胎仔致死性)的预防,而不是生育力的恢复。虽然以下的说明书建议是为了降低与原形药物相关的EFD风险,但同样的方法也可用于需要关注的代谢产物(如遗传毒性代谢产物)。
对于含有生物制品部分和小分子部分的偶联药物,申请人应考虑这两部分的说明书建议。例如,对于具有遗传毒性载荷的ADC,预计具有致畸性或胚胎-胎儿致死性,申请人人应使用表1中的说明书建议。如果药物由两个生物制品分子偶联而成,该药预计不具有致畸性或胚胎-胎儿致死性,则申请人应使用表2中的说明书建议。申请人应提供所提议的说明书建议的科学合理性证明。
1.男性
遗传毒性药物可能造成精子DNA损伤,从而可能对其女性伴侣的胚胎或胎儿产生不良影响。尽管没有关于接受抗肿瘤药物治疗的男性患者的后代畸形增加的报道(Trasler,Doersken 1999;Mulvihill 2012),但没有停止治疗后一年内出生的儿童的影响进行了充分研究的报道。此外,当给予遗传毒性药物的雄性动物与未给药的雌性动物交配时,在动物中观察到不良的胚胎-胎仔影响。在停止治疗后3个月内采用避孕措施(参见表1)将使遗传毒性药物的胚胎-胎儿不良影响的风险降至最低。3个月覆盖了精子发生和附睾成熟的周期。
2.女性
遗传毒性药物可能直接影响胚胎或胎儿,或可能造成卵母细胞DNA损伤。卵泡发育周期大约是6至12个月(Meirow等. 2001;Meirow,Schiff. 2005)。在卵泡发育的起始阶段暴露于遗传毒性药物主要导致卵泡丢失(Kalich-Philosoph 等. 2013)。尽管受损的卵泡可能通过卵泡闭锁的自然过程而被进一步清除,但在卵泡生长的不同阶段给予遗传毒性药物环磷酰胺的小鼠的后代中已观察到胚胎-胎仔不良影响,包括畸形(Meirow等. 2001;Meirow,Schiff 2005)。遗传毒性药物停止治疗后避孕6个月的说明书建议(见表1)涵盖了卵泡发育的生长和成熟阶段,并预期可消除大部分受损的卵泡和卵母细胞。偏离本说明书的建议若有正当理由是可以接受的。例如,对于仅为非整倍体剂的药物,1个月的避孕期(外加5个半衰期)通常是可以接受的,因为只有正在分裂的卵母细胞才受到非整倍体剂的影响。

1.男性
由于药物(或其代谢产物)通过精液转移给女性,理论上存在致畸性或胚胎-胎儿致死性的风险。尽管有报道显示,接受抗肿瘤药物治疗的男性的后代畸形率没有增加(Trasler,Doersken 1999;Mulvihill 2012),但没有对停止治疗后一年内出生的儿童的影响进行了充分研究的报道。
科学文献显示,包括沙利度胺在内的药物阴道内给药,在临床相关浓度下未造成胚胎畸形 (Hui等.2014;Breslin等.2014;Moffat等. 2014)。然而,更早期的一项研究显示,当雄兔给予沙利度胺时可致胚胎-胎仔不良影响(Lutwak-Mann 1964)。
虽然沙利度胺不会在精液中蓄积,但是许多小分子药物可以在精液中蓄积(Klemmt,Scialli 2005)。由于存在数据缺口,对于小分子致畸性药物,FDA建议避孕时间为5个半衰期。但是,对于致畸性生物制品,不需要避孕时间,因为这类产品未发现在精液中蓄积、吸收有限且可能由于阴道和子宫颈酶的存在而发生蛋白水解性降解(Scialli等. 2015)。避孕时间建议见表2。
2.女性
对于导致致畸性或胚胎-胎儿致死性的非遗传毒性药物,FDA建议在停止治疗后避孕时间为5个半衰期。对于不会导致致畸性或胚胎-胎儿致死性的药物,不需要避孕时间(见表2)。
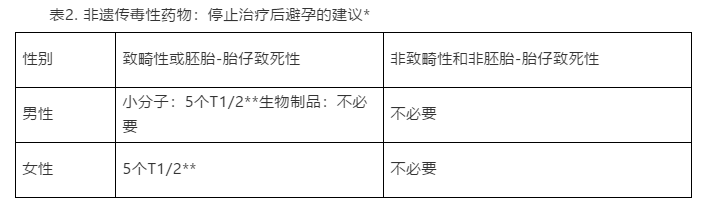
*本表也适应用于在遗传毒性试验组合中仅为非整倍体剂且非整倍体仅发生于高于临床暴露量若干倍时的药物
**对于半衰期短的药物(5个 T1/2 小于1周),FDA建议最短避孕期为1周。
指导原则原文:CDER,FDA. Oncology Pharmaceuticals: Reproductive Toxicity Testing and Labeling Recommendations Guidance for Industry (2019-5-9) https://www.fda.gov/media/124829/download
相关阅读:
1. ICH S9:Nonclinical Evaluation for Anticancer Pharmaceuticals(2009-10-29). https://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Safety/S9/Step4/S9_Step4_Guideline.pdf
2. ICH S9 Q&A: Questions and Answers: Nonclinical Evaluation for Anticancer Pharmaceuticals(2018-6-15).https://www.ich.org/fileadmin/Public_Web_Site/ICH_Products/Guidelines/Safety/S9/S9IWG_Document_Step4_QAs_CorrectedSecretariat_2018_0612.pdf
"我有问题问CDE"是一项帮助医药研发企业向CDE老师咨询提问的服务,也是参比购推出的一项免费特色服务,有提问需求的读者可以扫面下方二维码提交问题。

国家药品监督管理局药品审评中心药理毒理学部 黄芳华 王海学
声明:药研江湖对所有公众号产生内容保持严谨、中立的态度。文章仅供交流学习使用。如遇到内容有误,请与我们联系进行讨论和修改。(010-65104668)








