溶液澄清度作为一项药品质控项目被各国药典广泛收载,其在一定程度上可反映药品质量和生产工艺水平,综合控制由多种因素引起的药品质量的未知变化。
澄清度检查法系将药品溶液与规定的浊度标准液相比较,检查溶液的浑浊程度。
主要检查方法可以分为两种:目视法和仪器法。
欧洲药典(EP)和英国药典(BP)分别自EP5.0版和BP2005版在通则“溶液澄清度”中同时收载了目视法和仪器法,其具体内容分别在EP9.2版和BP2018版进行过修订,并明确两种方法可以相互替代。
《中国药典》(ChP)2015年版在原有目视法(第一法)的基础上新增了浊度仪法(第二法),并要求“除另有规定外,应采用第一法进行检测。第一法无法准确判断两者的澄清度差异时,改用第二法进行测定,并以其测定结果进行判断”。
澄清度是检查溶液的浑浊程度,即浊度。浊度是一种光学效应,是光线与溶液中的悬浮颗粒相互作用的结果。
悬浮固体会使得通过溶液的光线发生散射现象,使其产生浑浊,浊度表征光线透过溶液时受到的阻碍程度,是一个物理参数。
在一定浊度范围内,溶液的浑浊程度可以利用仪器进行定量测定,获得一个带有特定单位的数值。
国际标准化组织在ISO7027标准中对浊度单位给出了明确的定义,单位的复现依赖于福尔马肼(fomazine)标准溶液,规定1.25mg硫酸肼/L和12.5mg六次甲基四胺/L水中形成的甲臜聚合物为1度,单位为FTU(Formazin Turbidity Units)。
除FTU外,文献中常用的浊度单位还有FNU(Fomazin Nephelometry Units)和NTU(Nephelometric Turbidity Units),两者虽均为福尔马肼的散射浊度单位,但最初源于不同的专用仪器,并延续至今。
但无论何种浊度单位,由于其均基于上述的福尔马肼标准溶液定义,故测定福尔马肼标准溶液时的示值应一致。
但由于不同仪器的设计差异,不同类型的仪器仅在低浊度范围(不超过40NTU)时,采用FTU、NTU和FNU为单位的示值相当。因此应留意采用不同类型的仪器,特别是浊度示值单位不同的仪器得到数据间的比较。
浊度值是对溶液中所有物质总光散射效应的表征,由于分子散射现象的存在,即使最理想的纯水亦产生浊度,其数值约为0.010NTU或0.012NTU。
在溶液澄清度检查中,经常会遇到这样的问题:不同实验室间或同一实验室在不同实验日间,同一批次样品与按规定随行配制的浊度标准液相比较时,会得出截然相反的检查结论。特别是使用仪器法时,此类问题更为明显。
本文旨在找出上述问题的根源所在,并尝试给出适宜的解决方案。
文献报道,采用标准化的操作,通过与浊度标准溶液进行比对的方式,利用浊度仪进行准确测量,可最大程度上避免实验偏差。
因此,本研究采用统一的作业指导书对全部实验过程进行标准化操作,利用实验室间比对的方式,探讨ChP四部通则澄清度检查法中可能存在的问题。
1 材料与方法
1.1参加实验室
实验室共计14家:中国食品药品检定研究院、北京市药品检验所、上海市食品药品检验所;辽宁、江苏、江西、河南、广东、海南等省的药品检验院;无锡、大连等药品检验所;华北制药厂、新昌制药厂、海正药业等的药品检验室。
1.2仪器
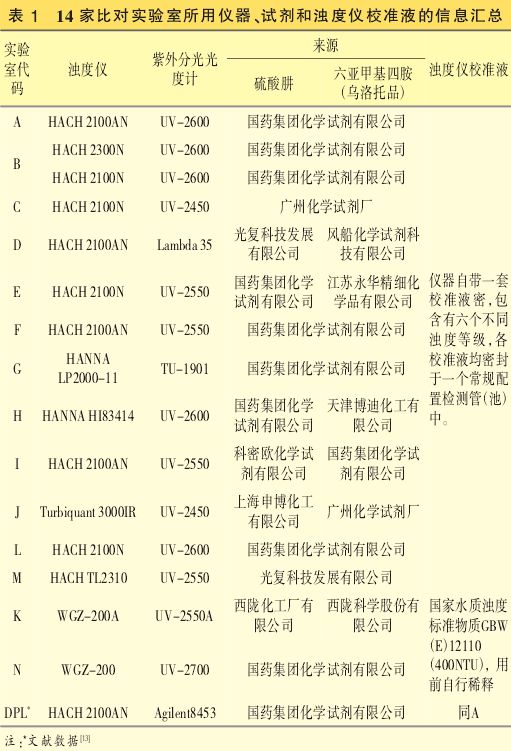
浊度仪共计9个型号:HACH2100N、HACH2100AN、HACH 2300N、HACH TL2310(均美国HACH公司);HANNA HI83414、HANNA LP2000-11(均意大利HANNA公司);Turbiquant 3000IR(德国Merk集团);WGZ-200A(上海昕瑞仪器仪表公司);WGZ-200(上海精密科学仪器公司)。
紫外分光光度计共计8个型号:Agilent8453(美国Agilent 公司);UV-2700、UV-2600、UV-2550A、UV-2550、UV-2450(均日本岛津公司);Lambda 35(美国Perkin Elmer公司);TU-1901(北京普析通用仪器公司)。
使用情况见表1。
1.3试剂
硫酸肼共计6个来源单位,见表1。
六亚甲基四胺(乌洛托品)共计6个来源单位,见表1。
上述试剂均为分析纯。
1.4方法
不同实验室间采用统一的标准化作业指导书,按ChP2020年版四部0902澄清度检查法和0401紫外-可见光光度法进行实验。
1.5方法比对作业指导书
1.5.1基本要求
各实验室由1名实验人员,按作业指导书要求,在三个不同实验日完成实验;每个实验日测定前,浊度仪应采用仪器自带的、在效期内的校准液进行校准。
浊度仪应在有效校准周期内。
1.5.2浊度标准贮备液的制备
按ChP2020年版四部0902澄清度检查法,配制浊度标准贮备液,并提供原始记录,方法比对全程中,须使用同一份浊度标准贮备液进行实验。
1.5.3浊度标准原液的制备
在第一、二、三实验日,分别取浊度标准贮备液20.0、15.0、10.0mL,各置1000mL量瓶中,加水稀释至刻度,摇匀,制成浊度标准原液SY1、SY2、SY3。
浊度标准原液可在48h内使用,用前摇匀。
注意:浊度标准原液SY1、SY2、SY3的紫外吸收值不需满足ChP2020年版四部0902中规定“在550nm的波长处测定,其吸光度应在0.12~0.15范围内”的要求,只需记录其在550nm波长处的实际紫外吸光度数值即可。
1.5.4浊度标准液的制备
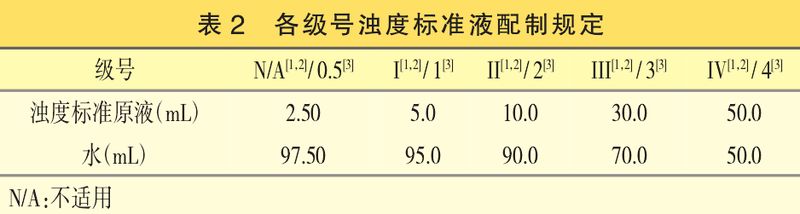
在第一、二、三实验日,分别取浊度标准原液SY1、SY2、SY3与水,按表2配制,即得。
浊度标准液应临用时制备并充分摇匀。
各级浊度标准液编号应与浊度标准原液SY1、SY2、SY3一一对应:浊度标准原液SY1对应浊度标准液S1-0.5、S1-1、S1-2、S1-3、S1-4;浊度标准原液SY2对应浊度标准液S2-0.5、S2-1、S2-2、S2-3、S2-4;浊度标准原液SY3对应浊度标准液S3-0.5、S3-1、S3-2、S3-3、S3-4。
1.5.5各浊度液紫外吸光度的测定
在第n个实验日(n=1、2、3),取浊度标准原液SYn和浊度标准液Sn-0.5、Sn-1、Sn-2、Sn-3、Sn-4适量,分别置1cm吸收池中,按ChP2020年版四部0401紫外-可见光光度法,在550nm的波长处分别测定其吸光度值;测定时每个溶液读取吸光度值两次,按仪器显示位数作原始记录。
1.5.6各浊度液浊度值的测定
在第n个实验日(n=1、2、3),取浊度标准原液SYn、浊度标准液Sn-0.5、Sn-1、Sn-2、Sn-3、Sn-4适量,各置于仪器常规配置检测管(池)中,例如:直径为25mm检测管,分别测定其浊度值;

如可行,再另取浊度标准原液和各级号标准液,各置于小容量检测管(池)中,例如:直径为13mm检测管,分别测定其浊度值。
操作注意事项:检测管(池)中加入适量溶液,应使液面完全超过浊度仪的入射光路,且每次测定时检测管中加入的溶液量需尽量保持一致。测定每个溶液的浊度时,需待浊度仪示值稳定后再读取浊度值。
2 结果与讨论
2.1各国药典中浊度标准贮备液、原液和各级号标准液配置规定的比较
福尔马肼具有良好的纯度和稳定性,其在溶液中可以形成不同长度的聚合物,并可以随机折叠得到颗粒大小和形态具有广泛性的浊度液,与供试品中可能存在的颗粒大小与形态近似吻合,因此各国药典均采用福尔马腓混悬液作为浊度标准贮备液,这与国际标准化组织在ISO7027标准中所给浊度值的溯源保持一致。
由于浊度单位的复现完全依赖于福尔马肼标准溶液,因此ISO7027对该标准溶液的配制进行了严格的规定,各国药典中浊度标准贮备液、浊度标准原液和各浓度浊度标准液的配制方法也均有规定。
EP9.2版和BP2018版虽然对原有EP5.0版和BP2005版通则“溶液澄清度”章节进行了修订,但浊度标准贮备液、原液和各级号标准液的配制要求并未发生实质改变。
将EP、BP、ChP和ISO7027中的配制过程进行比较:各国药典对浊度标准贮备液和浊度标准原液的配制要求基本一致(见表2),均为“按规定精密量取适量的浊度标准原液和规定量的水混匀”,而ISO7027则强调“按规定精密量取适量福尔马肼标准溶液加水稀释至规定体积”。
对EP、BP和ChP中浊度标准贮备液、原液和各浊度标准液的配制规定作进一步比较,其中,浊度标准贮备液配制中的最大差异在于是否将硫酸肼置于105℃干燥至恒重,ChP规定硫酸肼应在105℃干燥至恒重;
浊度标准原液配制规定中的最大差异在于是否在550nm波长处对原液的吸光度进行控制,仅ChP规定浊度标准原液的吸光度A范围应为0.12~0.15;
1~4(I~IV)号浊度标准液的配制规定保持一致,但ChP中收载了0.5号浊度标准液的配制方法。
除上述三点外,EP9.2版和BP2018版在修订时增加了对配制过程的温度要求,即全部配制应在(25±3)℃条件下完成。而ISO7027对配制过程的温度控制更为严格,要求应在(25±1)℃的恒温箱或恒温水浴中完成。
这些差异是否是造成不同实验室间或同一实验室日间误差的根本原因?
已有文献报道,在ChP2015年版四部0902规定的吸光度A范围(0.12~0.15)内,采用同一浊度标准贮备液配制的浊度标准原液具有不同的吸光度数值;
利用浊度仪测定各浊度标准原液的浊度数值,发现各标准浊度液的浊度值与其对应的紫外吸光度值间存在良好的线性关系,且ChP2015年版四部0902所规定的吸光度下限对应的浊度值仅为上限对应浊度值的75%。
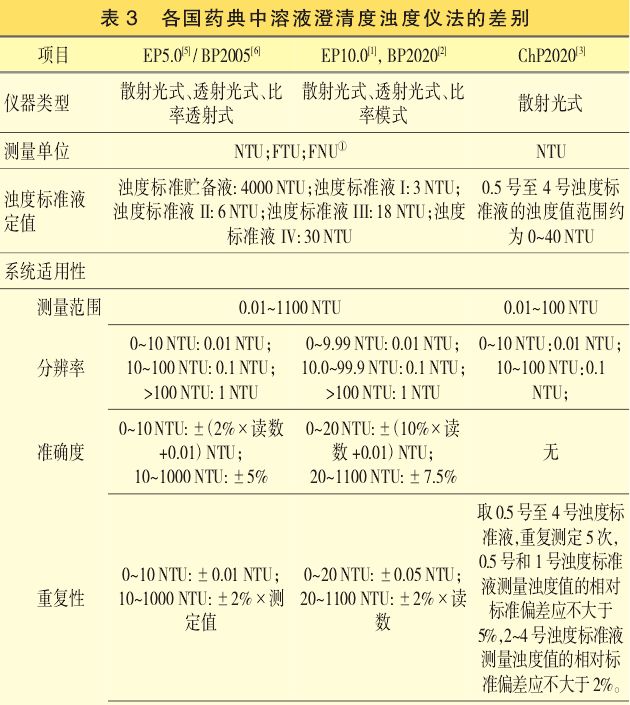
2.2各国药典中浊度仪法的比较
浊度仪利用入射光通过溶液时产生的透射光或散射光的变化来测量溶液的浊度。
与目视法比较,浊度仪测定不再依靠实验人的视觉敏锐度,可以提供一个无偏差的测定数值。
EP、BP和ChP在通则“溶液澄清度”章节中均已收载了浊度仪法,但在仪器类型、测量单位、浊度标准液定义值、系统适用性、供试品溶液检查、结果判定和其他要求等方面存在明显差异,且EP9.2版和BP2018版又对该章节中的规定进行了多处实质性修订,其差异见表3。

按照浊度仪使用规范和各国药典规定,浊度仪在使用前应采用浊度标准液对仪器进行校准,从而确保仪器示值可以正确溯源至ISO7027标准中定义的单位。
因此,采用不同的仪器测定不同浓度的福尔马肼标准溶液时,无论单位是否一致,测定结果都将具有可比性,这是实验室间比对的基础。
2.3实验室间比对结果
针对各国药典浊度标准贮备液、原液和各浊度标准液的配制规定,其中两个关键性差异引发思考:
①按各国药典规定制备的浊度标准贮备液的浓度是否一致?其浊度值是否均为其定义的4000NTU?
②ChP四部通则澄清度检查法中通过吸光度对浊度标准原液的浓度(浊度)进行质控,不同实验室间制备的浊度标准原液的浊度值与其紫外吸光度间是否存在定量关系?
为回答上述两点疑问,本研究对浊度标准贮备液、原液和各浊度标准液的配制方法开展实验室间的比对。
本次比对试验涉及14家实验室、共计15台浊度仪,浊度仪常规配置的检测管(池)容量约为20~30mL,其中6家实验室共计7台浊度仪还配备有容量为5~10mL的小容量检测管(池),此6家实验室同时采用常规检测管(池)和小容量检测管(池),分别测定同一份浊度原液或标准液。
对全部上报数据按不同容量的检测管(池)分别汇总,并进行数据处理。
首先,由于福尔马肼标准溶液的浊度值与其浓度成直线关系,故可利用各实验室浊度标准原液的浊度测定值和稀释倍数计算出浊度标准贮备液的浊度数值,其中,采用常规配置检测管(池)的计算结果见表4;采用小容量检测管(池)的计算结果见表5。
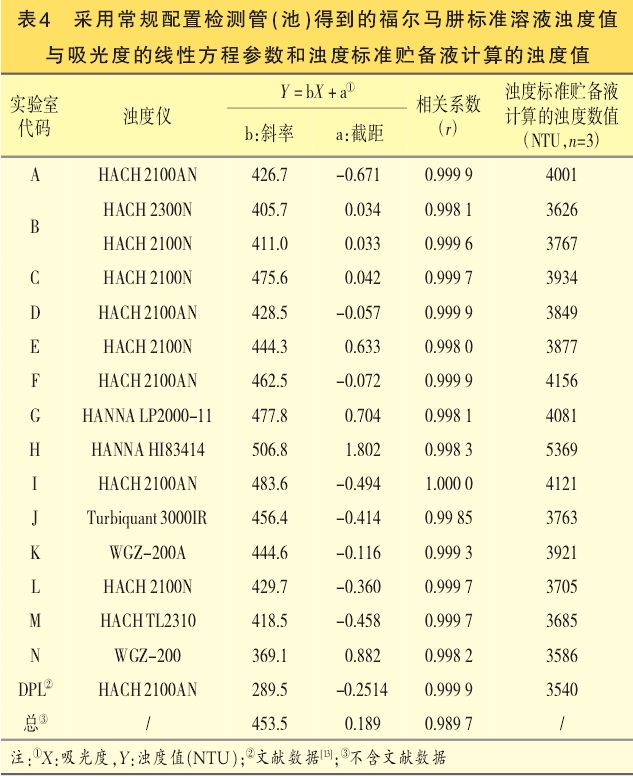
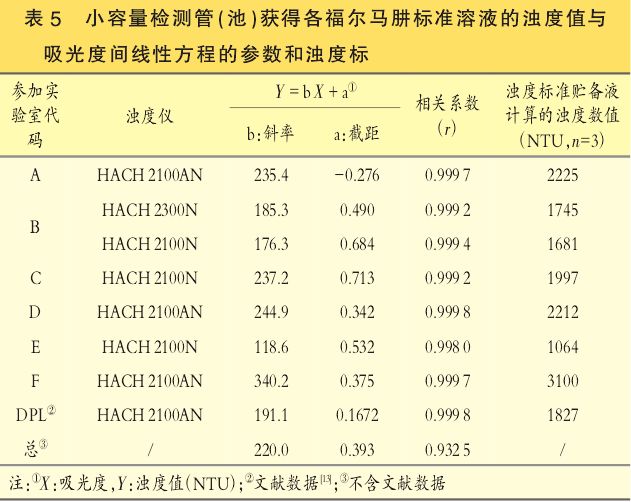
第二,假设福尔马肼标准溶液的浊度值与其在550nm波长处的吸光度数值成线性关系,利用各实验室的浊度数值(NTU)(Y)和对应的吸光度值(X)进行线性拟合,其中,采用常规配置检测管(池)的拟合方程参数见表4;采用小容量检测管(池)的拟合方程参数见表5。
2.4存在问题的探讨
2.4.1通过吸光度限值方式控制福尔马肼标准溶液浊度的合理性探讨
通过本次实验室比对试验,首先可以确认各实验室按ChP2020年版四部0902规定配制出的浊度标准贮备液的浊度并不一致。
由表4可知,各实验室所配制浊度标准贮备液中浊度最大值(实验室H)和最小值(实验室N)分别为5369NTU和3586NTU,两极值间相差约1.5倍,其中最小值与文献结果基本一致。EP10.0版和BP2020版中对浊度标准贮备液的浊度定义值均为4000NTU。
第二,在各个实验室内部,浊度标准原液、各级号浊度标准液的浊度值与其各自溶液在550nm处对应的吸光度数值呈良好的直线关系(见表4、表5),相关系数约为0.9999,与文献报道结果基本一致;
但汇总各实验室间的全部浊度值和吸光度值的拟合方程,相关系数却降至0.9,其原因为各实验室的拟合方程的斜率间存在较大差异(见表4、表5),其中具有最大、最小斜率值的浊度值和吸光度直线方程和文献报道数据间的比较由图1可见。
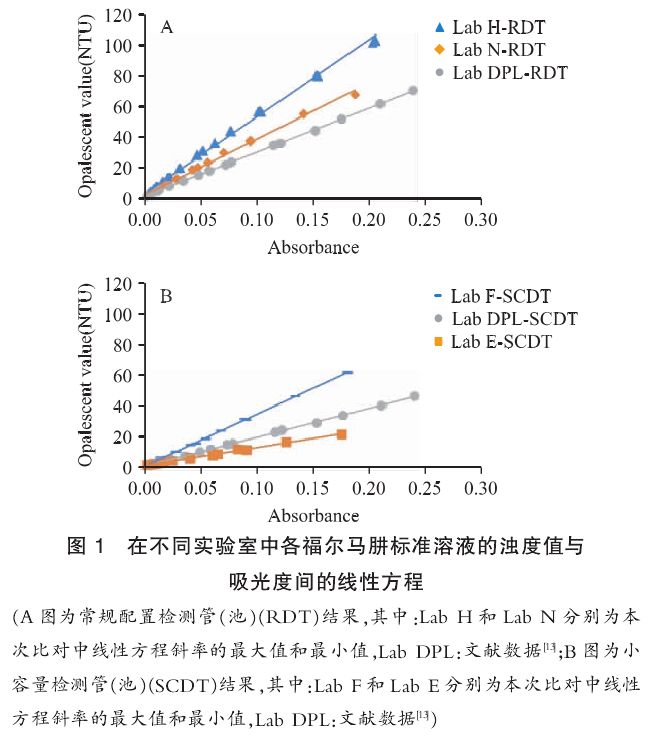
提示:不同实验室获得的福尔马肼溶液具有不同的浊度数值。
造成这一现象的可能原因主要包括两点:
第一,ISO7027标准中规定的各浓度福尔马肼标准溶液必须是硫酸肼和六次甲基四胺以1:10的质量比在水中形成的甲臜聚合物,该聚合物为具有不同长度且可以随机折叠形成的混合物,其形成过程需在(25±1)℃的恒温箱或恒温水浴中避光静置24h,再加适量水稀释至特定浓度间。
当配制浊度标准贮备液时,若硫酸肼和六次甲基四胺的比例或形成甲臜聚合物的过程发生变化,贮备液中聚合物的长度和随机折叠结构都将随之发生改变,使得混合物的属性出现差异。
第二,根据朗伯-比尔定律(Lambert-Beer law)对同一物质而言,在特定波长下其吸收系数为物理常数,因此可以利用吸光度对吸光物质的浓度进行控制。
综合上述两点原因:
在不同实验室间,按ChP四部通则“澄清度检查法”规定配制出的浊度标准贮备液中,甲臜聚合物混合物的属性可能出现差异,故各浊度标准贮备液的吸光系数将不再是统一的常数,此时将无法利用吸光度对浊度标准原液的浓度(浊度)进行有效质控;
但在实验室内部,由于浊度标准原液和各级号浊度标准液均由同一浊度标准贮备液稀释而成,则浊度值与其吸光度之间形成了良好的直线关系。
这就是造成“不同实验室间或同一实验室在不同实验日间、同一批次样品与按规定及随行配制的浊度标准液相比较时,会得出截然相反的检查结论”的根本原因。
举例说明,假设某批次原料药,其“溶液的澄清度”标准规定为:“如显浑浊,与Ⅱ号/2号浊度标准液比较,不得更深”。
采用浊度仪法常规配置的检测管(池)对其溶液浊度进行测定,浊度值为5.50NTU。
若按EP10.0版和BP2020版进行判定,Ⅱ号浊度标准液的定义值为6NTU,则该批原料药的澄清度符合规定;
若在本次比对中对该样品按ChP2020年版标准进行判定,根据表4中浊度值和吸光度直线方程参数,分别计算出吸光度A为0.12和0.15时——
实验室H(得到的浊度值-吸光度直线方程的斜率值最大)、实验室N(得到的浊度值-吸光度直线方程的斜率值最小)浊度标准原液的对应浊度数值,并根据稀释倍数关系计算出各实验室中各级号浊度标准液的浊度数值(考虑到数字修约和紫外分光光度计显示位数两个因素,代入计算的A值分别为0.11500和0.15499),其计算结果见表6。

将该批原料药的浊度值5.50NTU与表6中2号浊度标准液的数值进行比较,则吸光度A在0.12~0.15时,该批原料药的澄清度在实验室H、实验室N的判定结果分别为“符合规定”和“无法判定”,而采用文献数据则应判断为“不符合规定”。
2.4.2小容量检测管(池)使用过程中存在问题的探讨
由表4和表5结果可知,在同一实验室内部采用常规配置检测管(池)和小容量检测管(池)测定同一浊度标准原液,推算浊度标准贮备液的浊度值时会得到不同的结果,小容量检测管(池)得到的数值明显小于常规配置检测管(池)的结果,此与文献报道结果一致。
其原因是由于在校准仪器时仅对常规配置检测管(池)进行了校准(见表1),而未使用小容量检测管(池)对仪器进行校准,或对采用常规配置检测管(池)的校准结果按小容量检测管(池)进行修正。
本次比对仅实验室D在采用常规配置检测管(池)建立标准曲线的前提下,同时上报了以采用常规配置检测管(池)测定结果,小容量检测管(池)测定的修正和未修正结果,其修正结果与常规配置检测管(池)测定的结果间无显著性差异。
3 结论
本次实验室间的比对结果表明,ChP四部通则“澄清度检查法”存在两个方面的问题:
第一,其规定的浊度标准贮备液的配制方法,无法确保对浊度单位的准确再现,致使不同实验室或同一实验室、不同次配制的浊度标准贮备液的浊度数值可能存在较大差异。
第二,在浊度标准贮备液存在差异的前提下,利用控制吸光度的方法无法对浊度标准原液的浓度(浊度)进行有效质控,即具有不同浊度数值的浊度标准原液可能对应于相同的吸光度数值。
我们建议:
首先,提升《中国药典》四部通则0902第二法浊度仪法的检验地位,同EP10.0版和BP2020版一致,规定目视法和浊度仪法两种方法可以相互替代。
第二,将浊度标准贮备液、原液和各浊度标准液由自行配制修订为使用相关标准物质,并删除对浊度标准原液在550nm波长处吸光度的规定。
第三,对于浊度仪法,在保证仪器计量溯源性的前提下,可采用具体浊度数值作为限度判定标准,而非与各级号浊度标准液进行随行比较判定结果。
原标题:《<中国药典>四部通则澄清度检查法中可能存在问题的探讨》
来源:《药学与临床研究》
作者:王立新,马步芳,张培培,姚尚辰,胡昌勤,常艳(中国食品药品检定研究院 化学药品检定所)
声明:铭研医药对所有公众号产生内容保持严谨、中立的态度。文章仅供交流学习使用。如遇到内容有误,请与我们联系进行讨论和修改。







