新版《药品管理法》中,对“辅料”的定义是:生产药品和调配处方时所用的赋形剂和附加剂。
除活性物质成分 (API) 外,制剂所有药用成分均属于辅料。
辅料的功能包括提高生物利用度、实现特定释放与递送、优化生产工艺、增强药物稳定性、增强药物辨识度、提高患者顺应性等。
辅料是药品必不可少的组成部分,通常辅料用量明显高于 API,最多可占制剂总质量的 99% 。
辅料对 API 的释放、吸收、积累以及清除的影响,直接关系到药品的有效性和安全性。
长期以来,人们普遍忽视对辅料风险的控制,引发不少辅料药害事件:
企业将苯妥英钠胶囊中的辅料脱水硫酸钙变更为乳糖后,会导致苯妥英钠的生物利用度增加引起中毒;
辅料丙二醇被二甘醇(DEG) 污染的扑热息痛糖浆,导致多名儿童死于急性肾衰(2006 年中国“齐二药”药害事件中,因DEG 冒充辅料丙二醇造成 11 人死亡)。

针对国内辅料安全问题, 2006 年原国家食品药品监督管理总局发布了《药用辅料生产质量管理规范》,规范要求 辅料生产企业实施质量管理以确保辅料具备应有的质量和安全性。
2016 年, 欧 盟 发 布 了 辅 料 风 险 评 估 指 南(guidelines of 19 March 2015 on the formalised risk assessment for ascertaining the appropriate good manufacturing practice for excipients of medicinal products for human use) 作为 GMP 附录,要求上市许可持有人 (manufacturing authorisation holder,MAH) 对包括辅料在内的药品生产所有物料供应进行风险评估。
2017 年,在欧洲制药工业和协会联合会 (European Federation of Pharmaceutical Industries and Associations, EFPIA) 支持下,欧洲国际药用辅料协会 (IPEC-Europe) 和药品质量组织 (PQG) 开发了辅料风险评估模型 ( 图 1)。
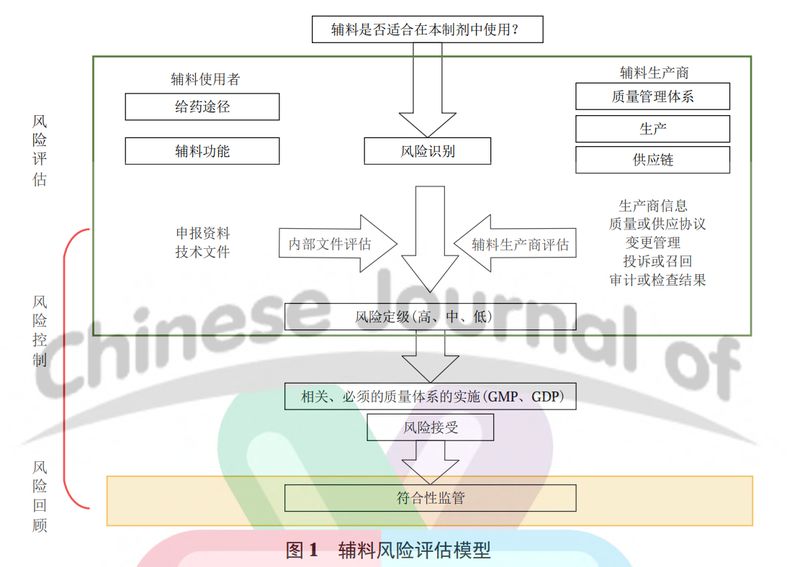
ICH Q9 将风险定义为“伤害发生概率和伤害严重程度的组合”,该模型将 ICH Q9 的基本原则与风险评估指南的特定要求结合在一起。该模型可以作为 MAH 对辅料生产商或供应商所提供的辅料进行风险评估的基本原则,同时也适用于监管方对辅料进行风险评估。
辅料风险评估过程强调了辅料使用者和辅料生产商在评估过程中应密切合作。
1 辅料风险评估的基本考虑
辅料风险评估及管理应基于科学知识,落脚点在于保护患者。
目前中国仅对辅料生产商提出具体的 GMP 要求以确保辅料质量,但尚未建立完善的辅料风险评估体系与指南,特别是对 MAH。
本文在欧盟辅料风险评估指南以及现有行业协会评估原则的基础上,从患者直接相关的实际临床用药出发,以辅料在制剂中的具体应用为切入点,从辅料给药途径、用药人群、每日用量和辅料功能相关性指标(functionality-related characteristics, FRC)4 个方面进行风险评估论述,为辅料风险评估提供借鉴。
1.1 给药途径
同一种辅料可用于不同给药途径的制剂,但辅料对接受不同给药途径患者的影响程度不同。
例如,注射液中抗氧剂若不能发挥拟定的功能,那么其危害比在乳膏剂中更大。
IPEC 按给药途径对辅料风险进行如下排序 :局部用药 < 口服、阴道和直肠用药 < 肺部、吸入用药 < 肠外、眼用和开放伤口用药。
中国辅料登记备案时,将用于注射剂、眼用制剂、吸入制剂等的药用辅料定义为高风险辅料。
因此在选择辅料时,首先应根据给药途径确定其风险等级,对于用于注射、眼用、吸入以及开放伤口的制剂,其制剂中辅料均属于高风险辅料。
应当注意的是,用于注射、眼用、开放伤口途径的辅料必须是无菌的,注射液必须对辅料进行内毒素控制。
评估高风险辅料供应商变更前后辅料质量的一致性,建议从制备工艺、内控标准、杂质水平、微生物水平等方面进行评估。
应重视影响产品安全性和有效性的功能性辅料的质量评估。
滴眼剂中使用的聚合物 [ 如结冷胶 (gellan gum)、羟乙基纤维素等辅料可起到调节药液黏度的作用,黏度与药液在体内滞留性能之间存在相关性。
即使不同供应商的辅料均符合药典标准,该类辅料的聚合度也可能存在一定差异,应特别关注聚合物的相对分子质量对药液黏度的影响。
1.2 用药人群
用于儿童、孕妇和哺乳期妇女药物中的辅料也被定义为“高风险”辅料。
相比于成人,儿童、孕妇等特殊人群对药物安全性的要求更为严格。以儿童为例,即使是已经常规用于成人药品的辅料,在用于儿童时仍需进行特殊的安全性考虑。
这主要是因为药物在儿童与成人,甚至不同年龄的儿童体内的药动学方面均存在差异。
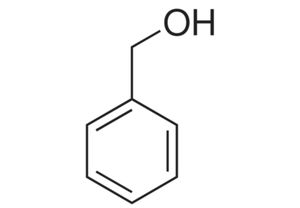
苯甲醇是一种防腐剂,在成人体内可代谢为苯甲酸,然后与甘氨酸结合形成马尿酸排泄。
但新生儿体内苯甲酸向马尿酸的转化率低,会引发致死性的代谢性酸中毒、呼吸和中枢神经系统 ( CNS) 抑制等不良反应。因此不建议在新生儿中使用苯甲醇。
欧盟说明书辅料指南(guideline on excipients in the label and package lea?et of medicinal products for human use)附件中,苯甲醇、硼酸、环糊精、丙二醇及酯类等辅料明确给出了儿童用药警示。
欧洲儿科处方倡议组织 (EuPFI) 的儿童辅料数据库 (safety and toxicity of excipients for paediatrics) 也收载了部分与儿童用药安全性相关的辅料信息。
为严格控制用于上述特殊人群辅料的质量和安全性,可适当提高辅料的质量标准以及辅料供应商的评估要求。
1.3 每日用量
给药量与年龄、疾病进展程度等相关。
药物给药频率不同,则患者每天摄入的辅料量不同;日辅料用量越高出现不良反应的可能性越高,风险也就越高。
已有文献报道根据辅料的最大用量情况对辅料进行风险低中高等级划分。
低风险 :辅料日最大用量在药物辅料数据库最大用量范围内的,如FDA 非活性成分数据库 (inactive ingredient database,IID) 等。收载于其他辅料数据库或者权威文献的辅料,也可酌情考虑。
中度风险 :通过比较辅料日最大用量与可接受的日摄入量 (ADI)、每日允许摄入量 (TDI) 以及无可见有害作用水平 (NOAEL) 三者中的一个,当用量相差 100 倍以上时可认为属于中度风险。
高风险 :系指尚没有安全用量支持性数据以及给药途径使用经验的辅料。
辅料用量评估可能使用到的辅料数据库包括以下几种。
① IID 提供了 FDA 已批准药品中最大辅料的用量信息,包括辅料型号、给药途径、剂型以及单剂量中最大用量,每季度更新 1 次 。网址:https://www.drugfuture.com/fda/IIG_query.aspx

该数据库的缺陷是未体现每日用药数量,因此无法确定每日辅料最大用量,目前 FDA 也有计划对这方面数据进行统计。
② 日本《医药品添加物事典》( Japanese Pharmaceutical Excipients,更新至 2016 版 ) 收载了已有的药用辅料,且确认了用药途径和用量;
《医药品添加物规格》(Japanese Pharmaceutical Excipients,更新至 2019 版 ) 收载药典以外辅料的质量标准。网址:https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000198369.html
此外日本医药品添加剂协会官网可在线查询辅料毒性的相关信息。
网址:https://www.jpec.gr.jp/detail=normal&date=safetydata/data.html
③局部给药途径的辅料可以在 cosmetic ingredient review(CIR)数据库中搜索有关安全性的信息。
网址:https://www.cir-safety.org/ingredients
因为局部用药和化妆品给药途径比较接近,化妆品中已有的辅料信息可以提供一定的安全性支持依据。
叔丁基氢醌 (TBHQ) 在软膏中的作用是抗氧剂,CIR 数据库中 TBHQ 的资料表明 TBHQ在至少 266 种化妆品中使用,浓度为 0.1%~ 1.0%。此外,口红中的 TBHQ 用量信息也可为确定其在口服药物中的用量提供一些参考。
④粮农组织 / 世卫组织食品添加剂联合专家委员 (Joint FAO/WHO Expert Committee on Food Additives,JECFA) 数据库中,提供了部分辅料的 ADI 以及安全性评估报告。
网址:http://www.who.int/foodadditives-contaminants-jecfa-database/search.aspx

1.4 辅料功能相关性指标 (FRC)
FRC 对制剂的关键质量属性 (CQA) 可能有重要影响。
有些辅料能对药效产生显著影响,如具有缓控释功能的辅料可显著影响药物的体内释放行为,此类影响药物体内行为的辅料按功能性,归属于高风险辅料。
辅助制剂生产的辅料如对药物 CQA 有影响的,按功能性归属于中度风险辅料,如片剂填充剂的类型或比例变化可能影响片剂的溶出度等;
片剂中的润滑剂可以使生产过程顺畅,同时也影响制剂的含量均匀度和溶出速率等 CQA,进而可能影响生物利用度,特别在低剂量固体制剂中影响更明显。
辅料改变对产品 CQA 无明显影响的则归属于低风险辅料,如包衣材料的色素。
按功能性评估被认为是属于低和中度风险的辅料,如果属于药典未收载辅料或者药典收载却未对FRC 进行研究的辅料也应认定为高风险辅料。
对于此类辅料,如果药物开发期间对 FRC 进行了研究,并且确定了其对产品质量的影响,那么这类辅料可以归为低风险辅料。
美国药典 ( USP) 和欧洲药典 ( EP) 采取了 2 种不同方法对 FRC 进行要求。
USP1059 Excipient Performance 通则中,以不同剂型的功能进行辅料分类,提供了此类辅料可能影响功能性的理化性质以及检测方法,如片剂和胶囊剂的填充剂的粒径、堆密度、晶型、水分等。USP 未在辅料正文中规定 FRC 检查。
EP 在部分辅料正文中列入 FRC 及检测方法,如收载微晶纤维素和羧甲基硫酸钠共处理辅料的黏度作为 FRC 指标。
实际药物开发及上市生产中存在辅料变更情况,例如辅料生产商变更、辅料生产工艺变更或者辅料批间差异等。
这些变更可能会对辅料的理化特性产生影响,如不同生产工艺微晶纤维素的物理特性和可压性不同;不同批次间乳糖因晶型变化,可压性存在差异;不同批次间辅料的反应性杂质水平差异对产品质量产生影响等。
MAH 应从辅料功能性角度重点关注辅料变更的风险。上市申请时应确保关键临床批次和商业放大批次间辅料的一致性或可衔接性,包括生产商、生产工艺以及质量控制。
如果影响产品质量的关键辅料存在显著差异,那么有可能需进行制剂生物等效性研究。
2 辅料风险管理的思考
辅料风险管理应建立在风险评估的基础上。
辅料的质量管理要求以及采取的管理措施应与风险程度相对应。
辅料风险应当是全生命周期管理,MAH、辅料生产商或供应商、监管方都应建立适当的辅料风险管理体系
2.1 MAH
新版药品管理法明确了药品 MAH 对药品质量全面负责,包括辅料的安全及质量管理。
欧盟辅料风险评估指南强调 MAH 应对辅料生产商进行全面、持续的风险管理。
辅料质量控制应当满足适当的 GMP 要求,辅料的管理应当纳入 MAH 的药物质量管理体系,辅料风险评估文档应在现场提供以供 GMP 检查员审查。
MAH 在药物开发过程中应当与辅料生产商或供应商深入交流,完成制剂中的辅料风险评估。
应充分研究高风险辅料对产品质量的影响,结合自身产品特性对辅料质量提出要求。
需要考虑辅料的来源 ( 如动物、植物、矿物,合成 )、病毒污染、供应链复杂性、供应商历史、包装完整性、贮存和运输条件等因素。根据评估结果制定相应的风险管理措施,如适当的供应商审计、签订质量协议、增加 FRC 的检查要求以及持续的风险控制计划。
药品上市申报时,高风险辅料应当与辅料生产商建立质量保障体系的监督机制。
2.2 辅料生产商或供应商
辅料的质量是生产出来的,辅料生产商需确保辅料生产满足适当的 GMP 要求。
中国现已建立了原辅包关联审评,辅料生产商需要向 MAH 提供辅料的授权使用书。这项政策的优势在于,能够使辅料生产商清楚自己所生产辅料的具体用途,因此对于辅料生产商的要求也有了进一步提高。
原辅包备案登记要求辅料生产商或供应商提交年度报告,产品如变更,需要登记变更信息、告知制剂生产企业或MAH 企业、写入年度报告。
辅料生产商应当逐渐积累辅料实际使用的基本经验,必要时可以为 MAH提供使用建议。
2.3 监管方
建议监管方从以下 4 个方面加强管理。
首先发挥引导作用,鼓励 MAH 和辅料生产商建立辅料风险评估的思维,充分借鉴国际先进监管机构及行业组织的管理经验,建立科学有效的辅料管理体系。
其次,辅料备案登记平台的智能化与信息化,对辅料登记后的变更实现清晰、完整、全面的管理。
探索建立辅料变更的分级管理机制,对于可能对产品安全性及质量产生重大不利影响的辅料变更,应能够及时预警、及早介入。
另外,应完善辅料数据库的基础建设,结合药物临床使用情况,及时更新和公布辅料使用信息。
最后,建议实时公布存在安全性问题的辅料清单。可参考欧盟,在药品说明书中提供辅料可能存在的安全性问题。
3 展望
辅料是影响产品安全性和有效性的重要因素之一。
建立科学的辅料管理是一项重要的课题,应当联合辅料使用者、生产商、监管方以及行业协会共同完成。
无论是辅料使用、生产还是监管,应当建立风险评估的意识,对辅料采取“适当”的管理。
但目前对于辅料风险管理,各国监管机构尚无具体可执行的成熟指南。
随着辅料风险评估的积累,计算机系统建模评估可能会成为未来辅料风险管理的重要技术手段。
MPI 公司已设计并验证了辅料风险评估工具 (risk assessment tool for excipients, RATE, https://pda.inloop.com/en/article/70999),提供了一个辅料风险评估的数据平台,以确保辅料符合欧盟 GMP 要求。
RATE 通过评分确定对辅料生产商及 GMP 控制的要求。
此外,也有以辅料安全性、质量和功能为参数的辅料风险评分模型。还有以制剂生产工艺、剂型以及辅料功能为参数进行辅料风险评估的模型。
这些积极有益的探索和积累,为辅料的筛选决策和风险评估提供了借鉴。
原标题:《药用辅料风险评估及管理的策略》(有删改)
来源:《中国医药工业杂志 》
作者:马骏威,安娜(国家药品监督管理局药品审评中心 )
声明:铭研医药对所有公众号产生内容保持严谨、中立的态度。文章仅供交流学习使用。如遇到内容有误,请与我们联系进行讨论和修改。







