6月21日,印度Hetero Labs公司宣布:其生产的瑞德西韦(商品名“Covifor”)已获得印度卫生部的上市批准,用于治疗该国的新冠肺炎患者。这将成为全球首个上市的瑞德西韦授权仿制药。
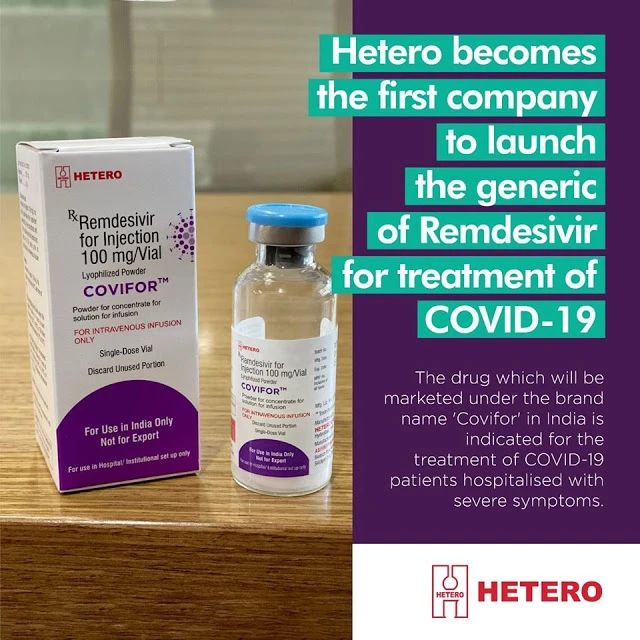
据悉,印度卫生部已于6月初批准瑞德西韦用于治疗有严重疾病症状的疑似或实验室确诊的成人/儿童新冠肺炎患者。根据印度的推荐方案,该药的最长应用疗程为5天。
Hetero公司表示,由于Covifor获批准用于紧急用途,并且只能在医院/机构中使用,因此不会通过药店零售。对医院的供应预计将在一周内开始。
39天
北京时间5月13日,美国吉利德公司宣布与5家仿制药生产商达成授权协议,允许他们生产抗病毒药瑞德西韦,用于在127个低收入和中低收入国家,以及几个中上收入和高收入国家分销。
仿制药生产商有权自订销售价格,并且“免交专利费”,直到世界卫生组织(WHO)宣布新冠病毒疫情不再是全球健康危机,或者“直到除瑞德西韦或疫苗以外的产品被批准用于治疗或预防新冠病毒”,以较早者为准。
此后,吉利德公司又增加了4家公司的授权,让获得免费专利授权的仿制药生产商达到9家,其中在印度的有7家,埃及1家,巴基斯坦1家。
而这之后仅仅过了39天,Hetero公司就完成了生产线确认、技术转移、工艺验证乃至上市申报、包装设计、销售定价等等一系列工作,成为了全球首家生产出瑞德西韦授权仿制药的公司。
尽管最近在边境发生了一些不愉快的事情,但有一说一,印度药企的战斗力和敬业精神,还是很令人钦佩的!
关于授权仿制药
虽然叫做授权仿制药,但严格意义上来说,Covifor既不是仿制药,也不能算原研药。
因为仿制药可以与原研药在辅料等方面有不同,而授权仿制药的原辅包、生产工艺,都和原研药完全相同,只是在标签和说明书上不能使用原研药的商品名。
这也使得授权仿制药的上市可以省去很多工作和程序,更无需通过药物一致性评价,所以才能诞生39天上市的“奇迹”。
关于瑞德西韦
瑞德西韦是一种在研的抗病毒药物,最早用于治疗埃博拉病毒,后在治疗新冠肺炎上展现出一定潜力,目前多国正进行用瑞德西韦治疗新冠肺炎的临床试验。
北京时间6月1日晚,吉利德公布了中度新型冠状病毒肺炎住院患者SIMPLE三期试验的概要结果,与标准护理组相比,使用瑞德西韦5天疗程的对照组中,有65%的患者在第11天出现临床改善,10天疗程方案的研究数据还未成熟。
但据知情人士透露,印度相关机构已经了解目前瑞德西韦的临床试验结果,并决定不将该药的使用疗程延长至10天。
除印度外,5月1日,美国食品药品监督管理局(FDA)为瑞德西韦发放了治疗新冠肺炎的紧急使用授权(EUA)。5月7日,日本厚生劳动省(MHLW)“特例批准”瑞德西韦应用于治疗新冠肺炎。英国卫生部也于5月26日宣布,将允许一部分符合临床标准的新冠重症患者在治疗中使用瑞德西韦。
据了解,Hetero生产的瑞德西韦目前价格还未确定,但预计每瓶的价格将在5000卢比到6000卢比(约合人民币465~558元)之间。
声明:铭研医药对所有公众号产生内容保持严谨、中立的态度。文章仅供交流学习使用。如遇到内容有误,请与我们联系进行讨论和修改。(010-65104668)







