本期将进行药品稳定性试验的相关原则及内容的相关讲解。
药品的稳定性特指其保持理化性质和生物学特性不变的能力。若药品的稳定性差,发生分降解而引起质量变化,则不仅有可能使药效降低,而且生成的杂质还有可能具有明显的毒副作用,而影响药品使用的安全性和有效性。
所以,药品稳定性试验的目的是考察药物在温度、湿度、光线等因素的影响下随时间变化的规律,为药品的生产、包装、贮存、运输条件提供科学依据,同时通过试验建立药品的有效期,以保障用药的安全有效。
稳定性试验研究是药品质量控制研究的基本内容,与药品标准的建立紧密相关。稳定性试验研究具有阶段性特点,贯穿药品研究与开发的全过程。

稳定性试验分为:影响因素试验、加速试验与长期试验。
要求1: 影响因素试验用 1 批供试品进行(原料药或制剂)。加速试验与长期试验要求用3批供试品进行。
要求2:原料药供试品应是达到一定规模生产的产品。供试品量相当于制剂稳定性试验所要求的批量;原料药合成工艺路线、方法、步骤应与大生产一致。
要求3:药物制剂供试品应是放大试验的产品,其处方和工艺与大生产一致。药物制剂,如片剂或胶囊剂,每批放大试验的规模,至少应为10000片或粒。大体积包装的制剂,如静脉注射液等,每批放大规模的数量至少应为各项试验所需总量的10倍。特殊品种、特殊剂型所需数量,根据具体情况另定。
要求4:供试品的质量标准应与临床前研究及临床试验和规模生产所使用的供试品质童标准一致。
要求5:加速试验与长期试验所用供试品的包装应与上市产品一致。原料药所用包装应采用模拟小桶,但所用材料与封装条件应与大桶一致。实验室规模的产品仅可用作辅助性稳定性预试验。
要求6:研究药物稳定性,要采用专属性强、准确、精密、灵敏的药物分析方法与有关物质(含降解产物及其他变化所生成的产物)的检查方法,并对方法进行验证,以保证药物稳定性结果的可靠性。在稳定性试验中,应重视有关物质,特别是降解产物的检查和鉴定。
要求7:由于放大试验比规模生产的数量要小,故药品注册申请人应在获得批准后,从放大试验转人规模生产时,对最初通过生产验证的3批规模生产的产品仍需进行加速与长期稳定性试验。

原料药与制剂稳定性试验的内容和侧重点略有不同。原料药及主要剂型的稳定性重点考察项目见下表。

1、稳定性试验结果的界定
药品稳定性试验过程中,质量的变化主要按照具约品标准,并结合稳定性重点考察项目的要求进行检测和评价。
稳定性试验考察中,原料药的“显著变化”"是指其质量检验的结果已经不能满足其药品标准规定限度的要求。
制剂的“显著变化"定义为:
① 含量较它的初始值变化超过5%,或用生物或免投学方法检测效价时不符合标准限度。
② 任何降解产物超过了它的标淮限度。
③ 外观、物理特性和功能性检查(如颜色,相分离,重新混悬能力、结块,硬度,每次给药剂量)不符合相应药品标准的限度规定;但是,加速条件下有此物理特性的改变可以除外(如栓剂的软化,乳剂的熔化)。
④ pH不符合标准限度。
⑤ 12个剂量单位的溶出度不符合标准限度。

2、原料药物稳定性试验的内容
(1)影响因素试验:影响因素试验是将药品置于比加速试验更为剧烈的条件下进行的稳定性考察。其目的是探讨药物的固有稳定性,了解影响其稳定性的因素及可能的降解途径与降解产物,为制剂生产工艺、包装,、贮存条件和建立降解产物分析方法提供科学依据。
供试品可以用1批原料药物进行,将供试品置适宜的开口容器中(如称量瓶或培养皿),摊成≤5mm厚的薄层,疏松原料药摊成≤10mm厚的薄层,进行以下试验。当试验结果发现降解产物有明显的变化,应考虑其潜在的危害性,必要时应对降解产物进行定性或定量分析。
① 高温试验:供试品开口置适宜的洁净容器中,60℃温度下放置10天,于第5天和第10天取样,按稳定性重点考察项目进行检测。若供试品有明显变化(如含量低于规定限度)则在40℃条件下同法进行试验。若60℃无明显变化,不再进行40℃试验。
② 高湿度试验:供试品开口置恒湿密闭容器中,在25℃分别于相对湿度90%士5%条件下放置10天,于第5天和第10天取样,按稳定性重点考察项目要求检测,同时准确称量试验前后供试品的重量,以考察供试品的吸湿潮解性能。
若吸湿增重5%以上,则在相对湿度75%土5%条件下,同法进行试验;若吸湿增重5%以下,其他考察项目符合要求,则不再进行此项试验。恒湿条件可在密闭容器如干燥器下部放置饱和盐溶液,根据不同相对湿度的要求,可以选择NaCl饱和溶液(相对湿度75%土1%,15.5~60℃),KNO3饱和溶液(相对湿度92.5%,25℃)。

③ 强光照射试验:供试品开口放在装有日光灯的光照箱或其他适宜的光照装置内,于照度为4500lx士500lx的条件下放置10天,于第5天和第10天取样,按稳定性重点考察项目进行检测,特别要注意供试品的外观变化。
光照装置,建议采用定型设备“可调光照箱”,也可用光橱,在箱中安装日光灯数支使达到规定照度。箱中供试品台高度可以调节,箱上方安装抽风机以排出可能产生的热量,箱上配有照度计,可随时监测箱内照度,光照箱应不受自然光的干扰,并保持照度恒定,同时防止尘埃进人光照箱内。
④ 破坏试验:根据药物的性质必要时可设计破坏试验条件,探讨pH与氧及其他必要的条件对药物稳定性的影响,并研究分降解产物的分析方法。并对分降解产物的性质进行必要的分析。

(2)加速试验:加速试验是将药物置于模拟极端气候条件下进行的稳定性考察。其目的是通过加速药物的化学或物理变化,探讨药物的稳定性,为制剂设计、包装、运输、贮存提供必要的依据。
供试品要求3批,按市售包装,在温度40℃士2℃,相对湿度75%+5%的条件下放置6个月。所用加速试验设备应能控制温度士2℃,相对湿度士5%,设备内各部分温湿度应该均匀,适合长期使用,并能对真实温度与湿度进行监测.试验期间,于第1个月,2个月、3个月,6个月末分别取样一次,按稳定性重点考察项目检测。
在上述条件下,如6个月内供试品经检测不符合制订的质量标准限度要求,则应在中间余件下,即在温度30℃+2℃,相对湿度65%士5%的情况下(可用Na,CrO.饱和溶液,30℃,相对湿度64.8%)进行加速试验,时间仍为6个月。
对温度特别敏感的药物,预计只能在冰箱中(4~8℃)保存,此种药物的加速试验,可在温度25土2℃、相对湿度60%士10%的条件下进行,时间为6个月。

(3) 长期试验:长期试验是将药物置于接近实际贮存的条件下进行的稳定性考察。其目的为制订药物的有效期提供依据。实际贮存条件参考下图。
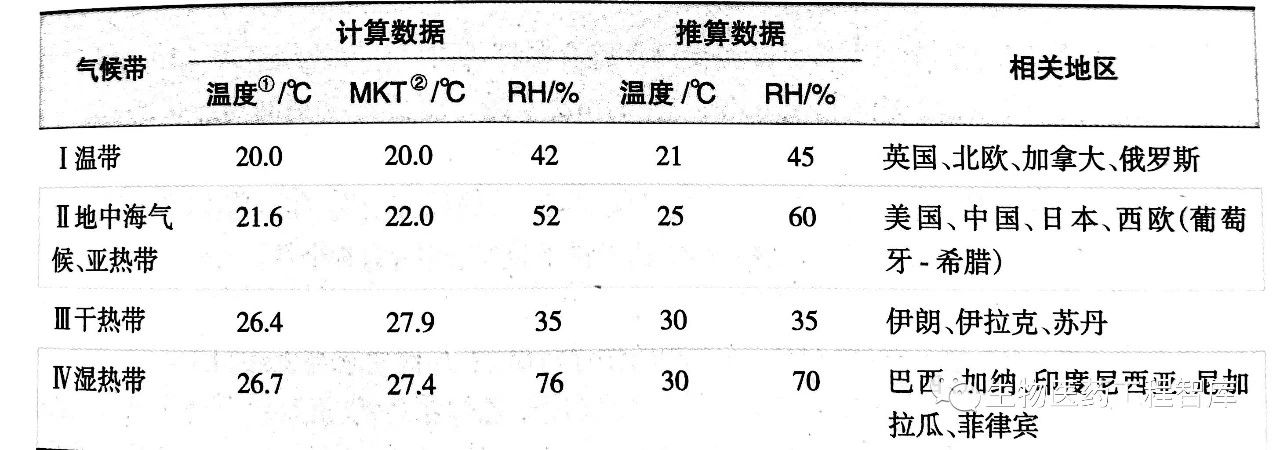
我国总体来说属亚热带(部分地区属于湿热带),故长期试验条件与国际协调委员会(ICH)采用的条件基本一致。供试品3批,市售包装,在温度25℃士2℃、相对湿度60%土10%的条件下放置12个月。考虑到我国南北方的气候差异,也可选择在温度30℃土2℃,相对湿度65%土5%的条件下放置12个月。
每3个月取样一次,分别于0个月、3个月,6个月,9个月,12个月取样按稳定性重点考察项目进行检测。12个月以后,仍需继续考察,分别于18个月、24个月、36个月取样进行检测。将结果与0个月比较,以确定药物的有效期。
由于实验数据的分散性,一般应按95%可信限进行统计分析,得出合理的有效期。如3批统计分析结果差 别较小, 则取其平均值为有效期;若差 别较大则取其最短的为有效期。如果数据表明,测定结果变化很小,说明药物是很稳定的,则不作统计分析。

对温度特别敏感的药物,长期试验可在温度6℃+2℃的条件下放置12个月,按上述时间要求进行检测,12个月以后,仍需按规定继续考察,制订在低温贮存条件下的有效期。
3、药物制剂稳定性试验的内容
药物制剂稳定性试验研究,应以原料药的性质和稳定性试验的结果为基础, 如温度、湿度、光线对原料药稳定性的影 响;并在处方筛选(原辅料相容性)工艺设计、包装选择的过程中,根据主药与辅料的性质,参考原料药物的试验方法,进行影响因素试验、加速试验和长期试验。
(1)影响因素试验:药物制剂进行影响因素试验的目 的是考察制剂处方、生产工艺和包装条件的合理性。
用1批供试品进行试验。将供试品,如片剂、胶囊剂、注射剂(注射用无菌粉末如为西林瓶装,不能打开瓶盖,以保持严封的完整性),除去外包装,置适宜的开口容器中,进行高温试验、高湿度试验与强光照射试验。试验条件、方法和取样时间均与原料药物的影响因素试验相同。
对于一些特殊制剂还需要进行低温/冻融稳定性试验研究考察。包括,难溶性药物的注射剂,考察冰冻后重新置于常温下的再溶解性能;凝胶等外用制剂,考察冰冻后复熔时凝胶体流变学性质的保持能力;以及脂质体、纳米粒等新剂型,冰冻后产生的冰晶可能会刺破微球体脂质膜,破坏剂型结构,导致包封家下隆,进而引发体内药动/药效行为等的不可预知的变化。

(2)加速试验:药物制剂加速稳定性试验的目的是通过加速药物制剂的化学蚊例理变化,松讨药物制剂的稳定性,为处方设计.工艺改进.质量研究、包装改进、运输,贮存提侠必要的依据.试验设备与原料药稳定性试验的要求相同。
供试品要求3批,按市售包装,在温度40 ℃土2℃,相对湿度75%士5%的余件下放置6个月。在试验期间,于第1个月,2个月、3个月,6个月末分别取样一次,按稳定性重点考察项目检测。
在上述条件下,如6个月内供试品经检测不符合制订的质量标准限度要求,则应在中间条件下,即在温度30℃土2℃,相对湿度65%土5%的情况下进行加速试验,时间仍为6个月。溶液剂、混悬剂、乳剂、注射液等含有水性介质的制剂可不要求相对湿度。
对温度特别敏感的药物制剂,预计只能在冰箱(4~8℃)内保存使用,此类药物制剂的加速过验,可在温度25℃士2℃、相对湿度60%土10%的条件下进行,时间为6个月。
乳剂、混悬剂、软膏剂、乳膏剂,糊剂,凝胶剂、,眼膏剂、栓剂、气雾剂、泡腾片及泡腾颗粒宜直接采用温度30℃土2℃、相对湿度65%土5%的条件进行试验,其他要求与上述相同.
对于包装在半透性容器中的药物制剂,例如低密度聚乙烯制备的输液袋、塑料安瓶、眼用制剂容器等,则应在温度40℃士2℃、相对湿度25%土5%的条件(可用CH3COOK·1.5H20饱和溶液)进行试验。

(3)长期试验:供试品3批,市售包装,进行长期稳定性试验,照稳定性重点考察项目进行检测。试验条件、取样间隔、数据分析、有效期的建立等,均与原料药物的长期试验相同。
对于包装在半透性容器中的药物制剂,则应在温度25℃土2℃、相对湿度40%士5%,或温度30℃士2℃相对湿度35%土5%的条件进行试验。
(4)配伍稳定性试验:对于临床使用时,需要临时配制成溶液再使用的药物制剂,还应考察配伍和使用过程中的稳定性,以防发生沉淀、分解变质等反应,为临床安全用药提供依据。

适用于药物稳定性试验样品质量检测的分析方法称为稳定性指示分析法。稳定性指示分析法应该能够准确检测出药物原料和制剂的质量随着稳定性试验考察因素的作用和时间的延长而可能出现的变化。
即,稳定性指示分析法应能够不受降解产物、工艺杂质、赋形剂或其他潜在杂质的影响,而准确测定药物中的活性成分,并能够定性和(或)定量地监测药物中的杂质(包括降解产物)。
稳定性试验中所用的含量测定方法应当具备稳定性指示能力。如果所用含量测定方法的专属性不能满足稳定性试验的要求,则必须增加能够进行杂质(包括降解产物)定性和定量监测的分析方法对其进行补充。所以,常用的稳定性指示分析法主要是色谱分析法,如HPLC,HPTLC等。
稳定性指示分析法建立时,为了保障其适用性,通常均要求在试验样品的制备、分析条件的建立和试验方法的验证3个方面进行全面的试验研究。

1、试验样品的制备
试验样品包括:起始原料、中间体,粗品原料、药物成品,以及将药物经过破坏(苛性)处理使主成分含量下降约5%~20%而包含分降解产物的样品.对于复方制剂,则需要对各药效成分既分别又合并进行破坏处理。
常用的破坏处理方法是将药物固体和(或)其适宜的溶液置于比加速和影响因素试验更为剧烈的条件下进行破坏,生成分降解产物。这样既可以满足考察稳定性指示分析法适用性的需要,又可以建立药物的分降解行为与途径,鉴定可能的分降解产物,并获得药物的内在稳定性特征。
从而为预测药物在贮藏过程中可能出现的分降解产物,并为药物的生产制备工艺、制剂处方工艺、包装与贮藏等条件的优化与建立提供参考。
药物的化学结构不同,理化性质有差异,其分降解行为也常常不同。水解、氧化、异构化或聚合等,是药物分降解的主要途径,并有可能出现多途径降解。所以,常用的破坏处理方法包括水解、氧化、高温和光照等,如下表。

当药物在通常的溶剂条件下的溶解度不合适时.,还可以添加适宜的有机溶剂助溶,以便有效地产生分降解反应。
破坏处理时,需同时制备:空白溶剂或辅料、平行破坏处理的空白溶剂或辅料、未经破坏处理的样品、平行破坏处理的单组分样品,以便识别和鉴定分降解产物及其来源。并可适当增减调整破坏处理的程度,以便获得破坏程度适宜的降解样品。
对于具有手性、多晶型或顺反异构的药物,还须特 别考察破坏处理过程中的手性、晶型或异构的转化。

2、分析条件的建立
常用的稳定性指示分析法均为具有良好分离能力和专属性的色谱方法。为了检验稳定性指示分析法的专属性和适用性,应采用起始原料、中间体、粗品原料及药物经过破坏处理生成分降解产物的样品,进行分离效能的考察,确保所使用的方法满足药物中活性成分的专属与准确测定要求,满足有关物质的定性和(或)定量检査的要求。
所以,在稳定性指示色谱测定条件的建立过程中,必须对主成分峰以及需要逐一进行定量测定的所有特定杂质峰,分别采用适宜的手段进行专属性的确证。专属性确证常用的方法包括:色谱峰纯度PDA或MS鉴定的直接检查法;改变色谓条件或色谱系统,考察和比较色谱峰分离的间接检查法;以及添加杂质对照的验证检查法。
由于分降解产物与药物活性成分常常具有明显的理化和色谱行为差异,所以,在药物杂质检查和稳定性指示分析测定中,梯度HPLC 的使用巳变得越来越广泛。例如,ChP中阿司匹林的有关物质检查,自ChP2010即采用了梯度HPLC,而在ChP2005相应标准中,除游离水杨酸外,没有进行有关物质的检查。
当然,稳定性指示分析法并不一定要使破坏产生的所有分降解产物均能够获得专属的分离。尤其是那些已经证明在加速和长期稳定性试验中不可能产生的杂质,在稳定性指示分析法建立事,可以不予考虑。

3、试验方法的验证
根据稳定性指示分析法的类型不同,应分别对方法的专属性、线性和范围、精密度、准确度、灵敏度和耐用性等进行必要的验证,结果应与选用方法的类型相适宜。
References:
[1]《药品质量生产管理规范》2010修订版
[2]《药品注册管理办法附件二》
ZK作者/ 伯格 编辑/ ZK主创们
声明:药研江湖对所有公众号产生内容保持严谨、中立的态度。文章仅供交流学习使用。如遇到内容有误,请与我们联系进行讨论和修改。(010-65104668)








