药物在体外的溶出行为,可以用来预测体内的崩解、溶出和吸收情况,同时药物体外溶出行为能够在一定程度上反映出制剂的质量。
溶出度测定是在药品生命周期中不同阶段监测溶出行为最有用的方法之一,广泛应用于药物开发、稳定性研究、互换性评价、常规质量控制、批量放大和批准后变更等各环节,且溶出度测定适用于各种剂型,如片剂、胶囊剂、透皮制剂、口服混悬液、混悬注射液等。
目前,已上市化学口服固体制剂药物质量标准中的溶出度试验,多为单种溶出介质、单点测定,方法有一定的局限性,对药物在生产过程中因原辅料、处方配比、工艺技术参数等关键要素改变引起变化的灵敏程度相对较弱。
溶出曲线特别是不同溶出介质的多条溶出曲线,可更加全面、灵敏地反映出上述关键要素的变化。
测定多种pH溶出介质中的溶出曲线是目前美国、日本等国家药物审评机构评价口服固体制剂质量的一种重要手段。该试验可用于评估不同来源的同一制剂内在质量差异。
日本自1998年开始实施“药品品质再评价工程”,陆续出版了《医療用医薬品品質情報集》(即日本参比制剂目录),详细列出了所收载制剂的4条标准溶出曲线。
2004年1月,美国食品药品监督管理局(Food and Drug Administration,FDA)药品审评中心仿制药办公室下属的生物等效部在其官方网站上推出了“溶出曲线数据库”。
近年来,随着仿制药一致性评价工作的深入开展,溶出曲线技术在我国化学仿制药口服固体制剂的质量评价方面得到了广泛应用。截至2020年5月底,已有超过200个品种通过或视同通过仿制药一致性评价,积累了大量的溶出实验数据。
在此基础上,开展我国口服固体制剂溶出曲线数据库研究,建立我国的溶出曲线评价体系,可以为上市后的口服固体制剂溶出曲线建立特征性的图谱数据库,为药品质量保持稳定和上市后药品质量监控提供技术支持和保障。
溶出度与溶出曲线
药物溶出度试验是反映药物质量的重要技术手段。
《中华人民共和国药典》(以下简称《中国药典》)2020年版四部通则规定,溶出度是指活性药物从片剂、胶囊剂或颗粒剂等普通制剂在规定条件下溶出的速率和程度,在缓释制剂、控释制剂、肠溶制剂及透皮贴剂等制剂中也称释放度。
溶出曲线是指药物溶出试验中,药物溶出量与时间的关系曲线。
在药物的质量标准中,溶出度测定方法的建立来源于溶出曲线方法,从某种程度上说,溶出度是溶出曲线的简化。由于溶出曲线测定的是多个点拟合成的曲线,对药物溶出行为趋势的表达,对药物生产过程中原辅料、处方配比、工艺参数变化的反映都比溶出度更直观。
研究溶出曲线的价值与意义
对于口服固体制剂而言,开展药物溶出曲线的研究具有重要的作用和意义。
药物上市前,通过溶出曲线研究药物在体外的溶出行为,可了解制剂内在特点,预测体内的溶解情况;可为临床生物等效性试验提供指导,提高生物等效性试验的成功率;可用于建立质量标准中溶出度试验方法,为药品质量控制提供保障。
药物上市后,具有区分能力的溶出曲线试验可用于药品生产过程中的质量控制,能够在一定程度上反映制剂的质量状况;可用于考察药物批内、批间的稳定性,为处方、工艺变更前后的质量评估提供指导;还可用于药物上市后的质量监管。
当药物溶出曲线中药物品种的数量达到一定程度,即可建立溶出曲线数据库,该数据库可为口服固体制剂的日常监管提供有力的技术支持,为药物研发提供科学参考。
溶出曲线数据库
美国FDA溶出曲线数据库
美国FDA建立溶出曲线数据库是为在美国药典(United States Pharmacopoeia,USP)中没有溶出度测试方法的药品提供相应的溶出检测方法,以帮助工业界开发仿制药产品。
对于USP中有溶出度测定方法的品种,FDA溶出曲线数据库中该品种的推荐方法显示为“参见USP品种项下溶出度测定方法”。
与日本采用4条曲线来评价药品质量所不同的是,美国通常选取其中1条最能反映内在质量的曲线,也就是最有区分能力的1条曲线。该数据库免费公开,每季度更新1次。
该数据库提供的信息包括国际非专利名称(International Nonpropietary Names for Pharmaceutical Substances,INN)、剂型、USP装置类型、转速、溶出介质、体积、取样时间点和最新更新日期。
截至2020年5月底,该数据库中共收载了1337种药品,其中50%以上药物是片剂,包括:缓释片、迟释片、口腔崩解片、分散片、咀嚼片、舌下片等;约有26%药品的剂型是胶囊剂;该数据库也收载了内用和外用混悬液、混悬注射液、眼和耳用混悬液的溶出度测定方法(约占2.5%);还约有2.5%的溶出度测定方法适用于透皮给药剂型,如:贴剂、膜剂等。
此外,还收载了其他剂型的溶出度测定方法,如:栓剂、散剂、颗粒、阴道环剂、阴道插入剂、植入剂、凝胶剂和咀嚼胶等。
FDA数据库中的溶出度测定方法覆盖了所有USP中收载的溶出装置(装置1-7),其中桨法(USP装置2)是最常见的装置,约占所有溶出度测定方法的70%,广泛适用于速释固体制剂的溶出度测定。
对于胶囊剂,可以采用沉降装置来防止上浮,沉降装置有螺旋形、沉降篮等。
数据库中也涉及一些非药典收载装置,例如使用Incubator Shaker来测定阴道环的溶出,使用Chewing Machine来测定尼古丁咀嚼胶。
日本溶出曲线数据库
日本《医療用医薬品品質情報集》中收录了经药品品质再评价工程确认、与原研药具有相同溶出行为的仿制药品1200余种,还记载了溶出度试验方法、质量标准、再评价进展情况等信息;尤其是给出了参比制剂在人体不同生理pH的多条溶出曲线,这对于未来的药品监管和预测药物在体内吸收等诸多方面均提供了强有力的技术支持。
因为大多数口服药物主要在消化道吸收,日本推荐采用4种不同pH的溶出介质来模拟消化道内的体液(分别为pH1.2、4.0、6.8和水)。
溶出介质中如加入表面活性剂(不可加入有机溶剂),应尽可能采用低浓度,更接近体内环境,增强对于不同来源的同一药品进行评价时的区分能力。
溶出试验中的转速为模拟人体消化器官的蠕动,随着人体年龄增长,蠕动亦越来越弱,所以药品在低转速条件下也能具有一定的释放,这样可保证其对于中老年患者的有效性。
数据库可提供日英文活性成分名、参比制剂、溶出试验和药品品质情报集等信息,可根据需要按照日英文活性成分名调整显示顺序。
参比试剂信息包括标准、活性成分、商品名、公司、含量、剂型、再评价指定日期等信息;溶出试验信息包括商品名、活性成分、剂型、含量、溶出曲线、表面活性剂、样品批号、溶出介质(标准溶液、其他溶液等)、转速、溶出速率、检测方法、该原料药的物理化学性质(主要有解离常数、在4种溶出介质中的溶解度以及在水中、不同pH的液体中和光照条件下的溶液稳定性)等信息,并附有溶出介质一览表。
与FDA不同的是,日本溶出曲线数据库有溶出曲线图例,对同一品种不同厂家之间不同溶出行为可进行直观比较,并且可以直观地反映参比制剂在不同介质条件下的溶出行为。
我国溶出曲线数据库建设及进展
我国溶出曲线数据库架构
从目前公开发表的文章以及FDA、日本药监部门的网站上无法查到美、日监管部门在审评监管中如何利用相关数据库开展工作,可以参考的是目前国际上已有一些国家如美国、日本发布的有关溶出的技术指导原则。
我国在2016年3月,为了配合仿制药质量和疗效一致性评价工作,针对药物的体外溶出方法建立,发布了《普通口服固体制剂溶出曲线测定与比较指导原则》。
上述指导原则可用于药物溶出曲线的研究。
随着仿制药一致性评价工作的深入开展,溶出技术在我国化学仿制药口服固体制剂的质量评价方面得到了广泛应用。药品监管机构可通过选取代表性品种,建立溶出曲线测定方法,研究溶出曲线相似度判定方法,开展体外溶出曲线方法学研究,最终建立具有适当区分能力以及一定耐受性的溶出曲线测定方法。
先对口服固体制剂溶出行为研究,再开展数据库结构设计、数据处理、数据提取等方面的探索性研究,接着建立我国化学仿制药口服固体制剂溶出曲线数据库的关键参数,最终确定我国溶出曲线数据库的关键要素及实施路径。
建立溶出曲线数据库不仅能为化学药品制剂的研发和科学客观地评价仿制药品的内在质量、提高生物等效性试验的成功率提供参考与指导,也能为上市后药品质量体系稳定性的监测以及上市后质量监管等工作提供技术支持和保障,并对促进我国化学药物质量评价的理念、技术方法与国际全面接轨,提升我国化学药物制剂的研究与质控的整体水平发挥其重要的作用。
对于化学仿制药口服固体制剂溶出曲线数据库建设,需要综合利用药物分析学、数学、统计学与计算机科学等多学科交叉知识,探索性研究建立溶出曲线数据库的关键要素。通过建设配套软件,为一致性评价工作提供方便、灵活的专业信息支撑。
该软件包括2个子系统,一是数据处理子系统,主要用于将收集的溶出曲线数据信息进行标准化工作,包括统一数据录入格式、浓度单位、测量时间、测量方法等,按照数据字典、数据标准的要求,进行深入标准化,挂接各个品种的横向、纵向关联关系;二是数据展示子系统,对化学仿制药口服固体制剂溶出曲线数据库提供查询、统计、检索等应用。
我国溶出曲线数据库建设进展
结合重大新药创制科技重大专项课题药物一致性评价关键技术与标准研究,药检机构已经建立了多个口服固体制剂品种的溶出度测定方法及溶出曲线数据,中国食品药品检定研究院参考国外已有的溶出曲线数据库,正在着手构建溶出曲线数据库系统。目前初步建立的数据库可提供的信息主要包括药品信息、参比制剂、检验机构、详细数据、溶出曲线、文件管理6个模块。
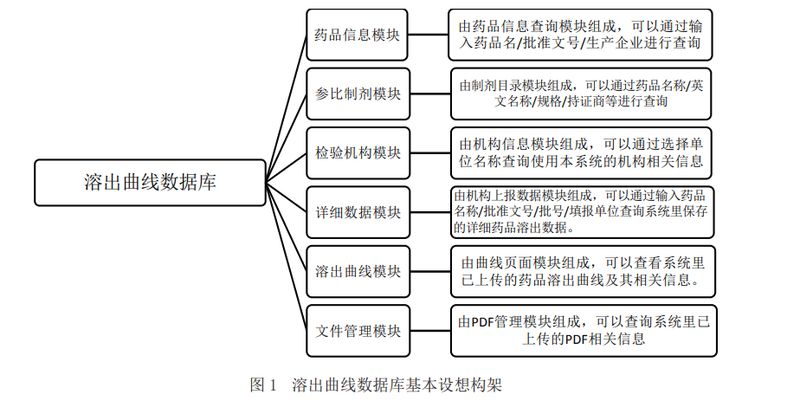
(1)药品信息模块由药品信息查询模块组成,可以通过输入药品通用名/批准文号/生产企业进行查询。
药品通用名查询,包括药品名称、成分/处方、适应症、不良反应、药理名称等信息的显示;批准文号查询,包括药品批准文号、批准日期、剂型规格等信息的显示。
生产企业信息查询,包括持证商、生产地等信息的显示。该模块与药品监管部门网站信息进行关联,保证药品名称的唯一性,批准文号和生产企业名称的准确性。还可扩展增加数据字典查询功能,对药品监管部门提供的相关数据字典,如药理分类、剂型、成分、基本药物目录、OTC药物目录、特药目录等数据库的显示。
(2)参比制剂模块由制剂目录模块组成,可以通过药品名称和序号进行查询。
该模块与国家药品监督管理局药品审评中心公布的化学仿制药参比制剂目录进行动态关联,保持数据的一致性。
参比制剂在数据库中的序号与参比制剂目录中的序号保持一致,数据库可提供参比制剂的药品名称、英文名称、规格、持证商、国内外上市情况等。
(3)检验机构模块由机构信息模块组成,可以通过选择单位名称查询使用本系统的机构及其相关信息。
该模块可设置所在地查询功能,以实现对省、市、区/县所在单位的查询和分析功能。还可通过该模块为使用客户进行分级开放权限,为管理者进行客户类型分析提供数据。
(4)详细数据模块由机构上报数据模块组成,可以通过输入药品名称/批准文号/批号/填报单位查询系统里保存的详细药品溶出数据。
药品溶出数据信息包括溶出介质、具体配制方法、溶出方法、溶出仪品牌、溶出仪型号、检测方法、转速、具体操作等内容。可根据需要按照药物名称首字母排序或更新日期先后调整结果显示顺序。
(5)溶出曲线模块由曲线页面模块组成,可以查看系统里已上传的药品溶出曲线及其相关信息。
溶出曲线系统可以直观地对溶出曲线进行比较,例如需要比较不同厂家的溶出曲线,先在筛选区选择需要对比的药品名称、生产企业、溶出介质以及样品编号等信息,点击执行后,筛选的溶出曲线将展示在展示区,如图2所示:
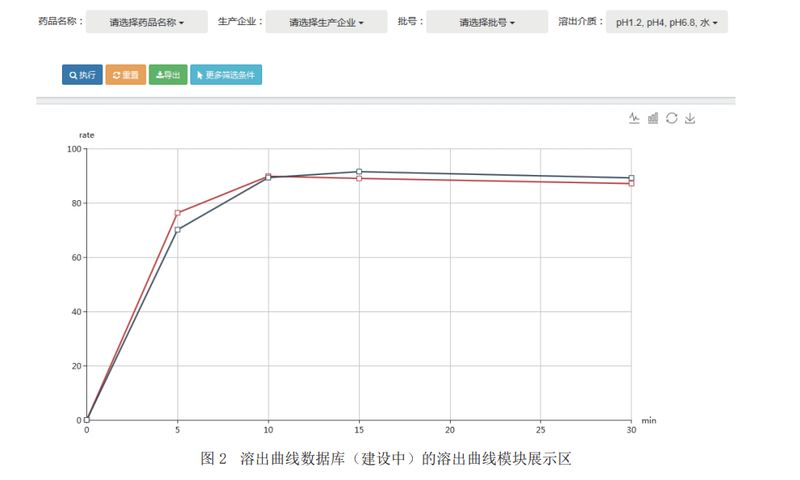
系统可以直观地显示不同厂家生产的同种药品在同一情况下的溶出情况。
溶出曲线系统可以将多个样品的溶出数据整合取平均值,例如需要将多个样品的溶出数据整合在一起(取平均值)进行比较,先在筛选区选择需要对比的药品名称、生产企业、溶出介质等信息,选择需要对比的样品编号,在“是否平均”选择处选择“是”,点击执行后,筛选后的溶出曲线平均值将展示在展示区。
(6)文件管理模块由PDF管理模块组成,用户在进行分析后,可通过该模块导出相应结果。
小结
溶出曲线数据库建立后如何为企业和药品监管部门服务是本项工作的难点。
向药品研发企业及科研院所开放溶出检测方法模块,可以为药学研究者提供溶出曲线信息查询平台,为化药制剂的研发和科学客观地评价仿制药品的内在质量、提高生物等效性试验的成功率提供参考与指导。
向药品监管部门开放溶出曲线数据及分析模块,可以比较上市后药品生命周期不同时间点(如上市后变更等)的溶出曲线变化,考察药品质量的稳定性和一致性。
特别是对于通过了仿制药质量和疗效一致性评价的品种,同一企业不同批次产品之间的特征溶出曲线如存在差异,通常可归因为生产工艺稳定性和产品稳定性等方面的问题。当产品质量一致性存在问题时,需要引起关注并加以解决,让一致性评价不要变成一次性评价。
文章来源:《中国药事》
原标题:《美、日溶出曲线数据库对比研究及我国溶出曲线数据库建设进展》
作者:刘倩,张广超,牛剑钊,许鸣镝(中国食品药品检定研究院,北京)
声明:铭研医药对所有公众号产生内容保持严谨、中立的态度。文章仅供交流学习使用。如遇到内容有误,请与我们联系进行讨论和修改。(010-65104668)







