在参比制剂购买的过程中,很多药厂对于办理一次性进口批件的流程存在很多疑问,对于要准备什么材料,申请材料怎么填写,证明文件需要怎样加盖公章等等问题不知如何处理,造成申请资料被打回重新准备,不仅耽误了时间,还延误了研发进度!
所以小编今天就给大家讲讲办理一次性进口批件的流程,由于各地要药监局的要求会有所不同,所以具体细节内容会有出入。
1、务必确保申请表与申请报告中的信息完全一致
2、需要签字盖章的文件有:申请表、申请报告、真实性声明、翻译一致性承诺书、参比制剂用途承诺书。
3、确保每一份文件上都有公章,单页文件加盖一个公章即可。申请表和申请报告除了在指定地方盖公章以外,还需要加盖骑缝章。上市证明性文件每一页一个公章。
4、文件需用牛皮纸文件袋装起来,并加封面。
江苏省《一次性进口药品资料申报指南》中对办理流程及说明内容比较完整详细,可以作为办理参考,后台回复“一次性进口”下载文件。
基本上一次性进口批件的办理主要有下面几个步骤:资料准备——提交资料——受理大厅形式审核——药品监督管理局审批——发放批件。一般情况顺利的话大概20天左右能够办理完成!

在办理一次性进口批件之前,需要做好充分的资料准备,主要包括下面这几部分:
1. 药品一次性进口申请表(纸质+RVT文件)
2. 药品一次性进口申请报告
3. 申请人资质证明性文件
4. 委托证明文件
5. 国内药品证明性文件
6. 拟进口药品的国外获准上市证明材料
7. 申请材料真实性保证声明
8. 药品用途承诺书
9. 翻译一致性承诺书
下面详细的说明一下每个部分包括的具体文件:
填写一次性进口申请表需要"药品注册申请报盘"程序,程序需要从“国家药品监督管理局行政事项受理服务大厅”网站下载最新版本。
《药品注册申请报盘程序》
下载地址: http://samr.cfda.gov.cn/WS01/CL0158/
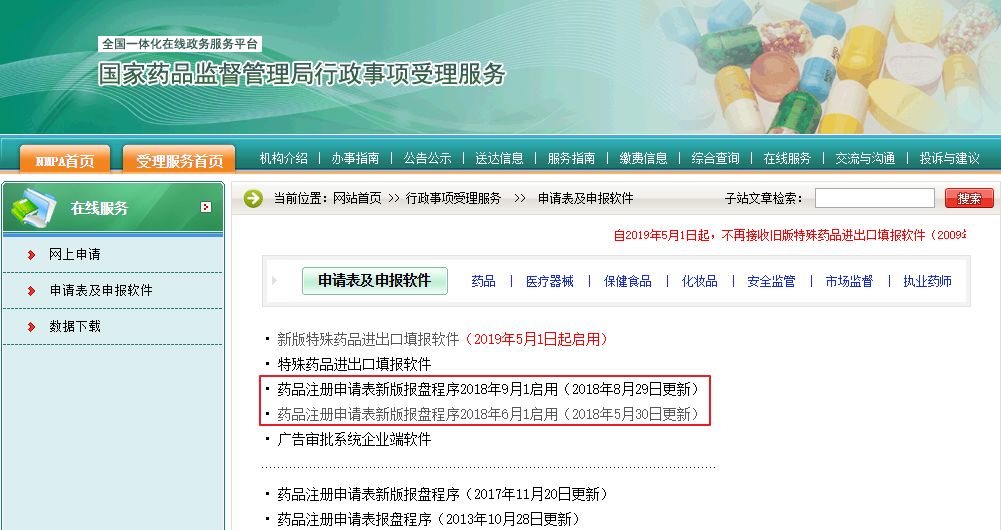
下载程序后直接解压打开程序,新建申请并填写相应内容,保存打印。
注:纸质版资料需盖骑缝章,同时需要将“.RVT”格式文件(RVT文件在报盘程序文件夹中的Print文件夹下)复制到U盘中备用。
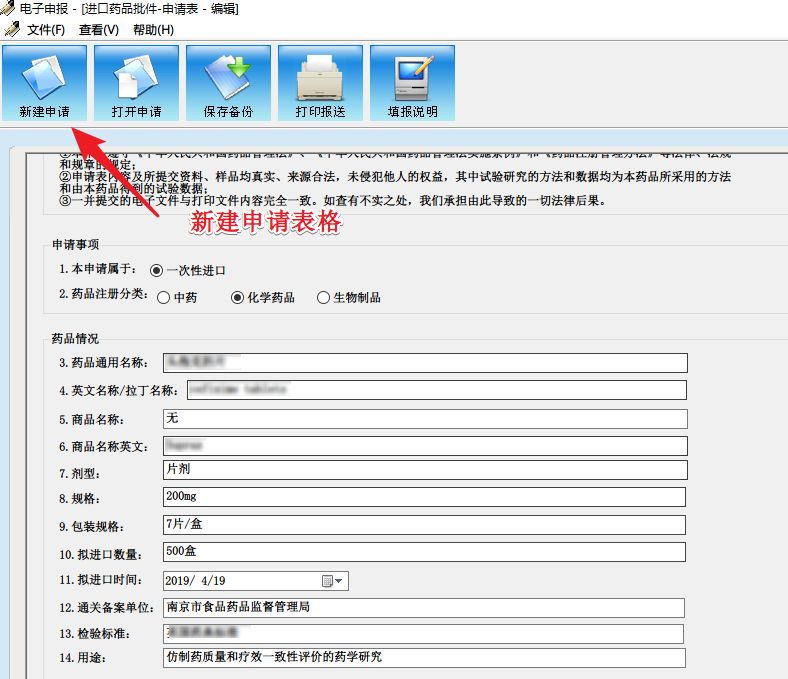
打印报送的时候会同时自动生成一份PDF格式申请表(注:申请表中“申请单位”一栏要加盖公章)

申请报告包括参比制剂境外上市情况,拟申请进口对照品的来源,拟申请进口对照药品的具体用途、数量、使用计划,拟进口药品的口岸,以附件的形式附NMPA或者FDA等官方网站上查询的生产企业地址。
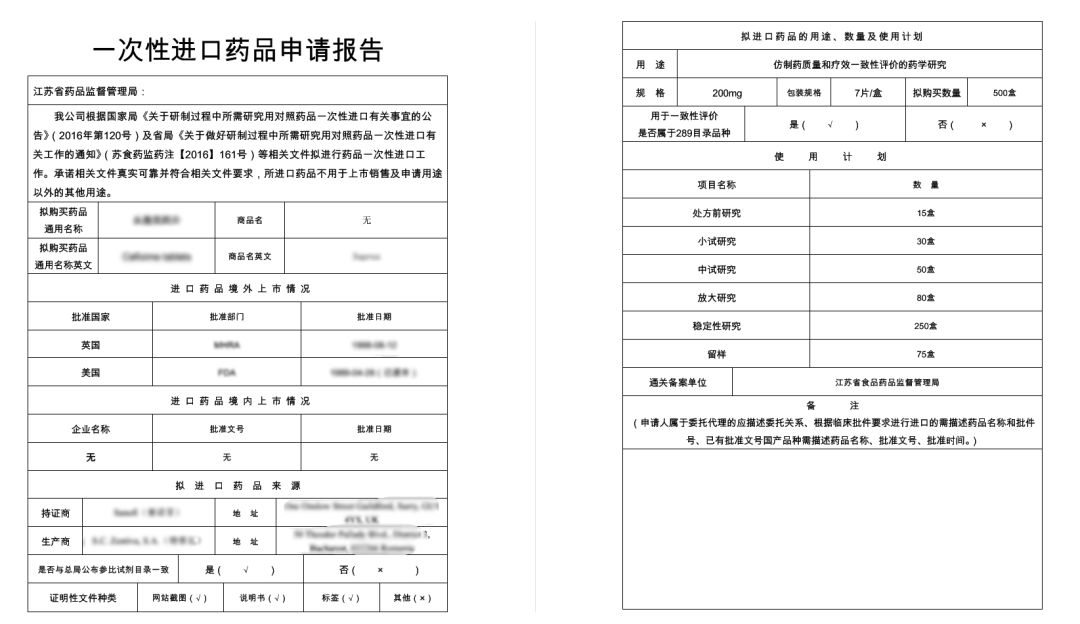
药品生产企业提供《营业执照》(复印件)、《药品生产许可证》(复印件);研发机构提供《营业执照》;受托代理机构提供《营业执照》:《GMP证书》(复印件)。
注:以上所有复印件都需要加盖公章、联系人身份证复印件正反面,盖公章。

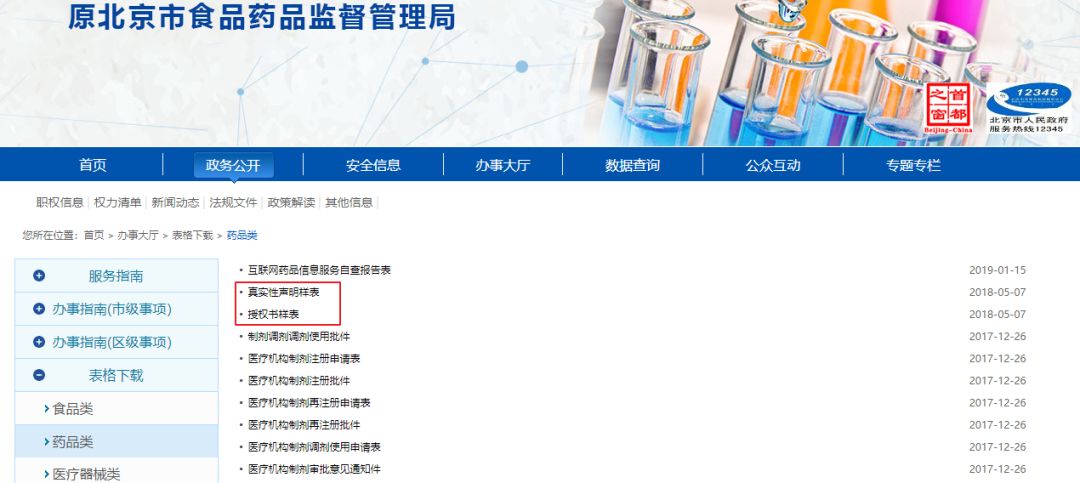
企业授权委托书、真实性声明,这里以北京局为例,从“北京市药品监督管理局”网站“办事大厅”中,下载《授权委托书》并填写,加盖公章及委托人签名,下载《真实性申明》加盖公章及法定代表人签字。
注:委托双方联系人的身份证正反面复印件,同时所有这些文件都需加盖公章。
文件下载地址: http://syj.beijing.gov.cn/bjfda/bsdt64/bgxz/351977/index.html
已获准上市的药品提供药品证明性文件复印件;根据国家总局批件要求开展研究的,提供批件复印件;非首次申请的,提供原《进口药品批件》复印件。属于其他情况的,应做出说明。
可提供上市国家药品监管部门核发的批准证明文件复印件、境外上市的药品说明书或上市国家药品监管部门网站公开信息等,以及生产商的相关材料。外文资料需提供中文译本。申请人机构合法登记证明文件复印件,即申请企业的有效营业执照副本复印件,加盖公章。
拟进口对照品的国外获准上市证明材料
(1)FDA批准信息:FDA查询到的批准信息截屏,并附截屏部分的翻译内容。
(2)说明书及译文:以附件的形式附上说明书及译文。
(3)包装及生产商信息:以附件的形式附原研内外包装及官网上查询到的生产商信息,包括生产企业名称及生产地址。
可从省市药监局网站下载模板,需申请人的法定代表人签字(印章),加盖申请人单位公章。申请属于委托代理的,需申请人和委托方法定代表人共同签字(印章),并加盖双方公章。非法定代表人签字的,提供法定代表人委托书。
注:参比购在帮助企业办理的过程中,在申请人一栏加入了“统一社会信用代码”

承诺书:承诺所采购的参比制剂仅用于药品注册的哪方面使用,不用于上市销售及申请用途以外的其他用途。
注:《参比制剂用途承诺书》里面的方框要用笔打上“√”

设计到翻译的所有文件(说明书译稿、检索结果译稿等),需要申请的时候同时提交翻译一致性承诺书,内容如下:
注:《翻译一致性承诺书》里面的方框要用笔打上“√”

1、资料封面,包括申请单位名称、单位地址、联系人姓名、联系人电话。
2、以上资料均需加盖公章,说明书及译文可盖骑缝章。

1、将整套资料按目录1、2、3分别装订,资料首页、目录页无需装订。

2、授权委托书,真实性声明,纸板申请表无需装订。
3、文件需用牛皮纸文件袋装起来,并加封面。
4、将所有资料及U盘统一放入档案袋中,档案袋封面加盖公章。
将资料提交至各省市的药品管理相关部门。取得受理通知书及缴费通知书后,5个工作日内汇款,汇款须注明受理号。
声明:药研江湖对所有公众号产生内容保持严谨、中立的态度。文章仅供交流学习使用。如遇到内容有误,请与我们联系进行讨论和修改。(010-65104668)








