写在前面的话
其实,本该写完含量测定方法开发就写这一篇,但是十一放了个长假,不出去玩一下不太合适,以及九月一时爽,十月火葬场,节后回来报复性拍到桌上一堆工作,于是稿子拖欠至今。让各位久等啦~~
系列文回顾(官网中请自行搜索):
项目负责人手记(一):一致性评价从准备到申报流程,让新人少走弯路!
项目负责人手记(二):固体制剂质量研究中含定方法开发
本文适用范围:主要针对采用高效液相色谱法进行含量含均的检查,气相色谱法和紫外-可见分光光谱法由于仪器不同,对结果的要求会有差异,试验内容基本相同。本文不适用容量法(滴定法)等其他方法。
确保方法开发内容各项足够全面。即使方法学验证方案在时间上区分出了开发阶段和验证阶段,但在思路上,二者不该有明显的界限。一个新品种的分析方法,理应足够准确、灵敏和耐用,可以经过时间和无数批商业化批次样品的考验。开发与验证的全面性和灵活性缺一不可,分析工作或许会贯穿品种的整个生命周期。
确定好方法学验证用样品,准备相关试剂、对照品、色谱柱等消耗品,确认所使用仪器都在校验有效期内,最后定稿方法学验证方案。——千百年来,兵马与粮草的关系,你们都懂的。
准备好强大的内心,应对突如其来的偏差、真假难辨的误差、以及千奇百怪的各种问题。对业内人士来说,排名第一的内心独白是要淡定,排名第二的内心独白还是要淡定。无偏差,不研发!皮一下很开心~~
废话不说,先上一个汇总款的超级无敌大表格,如下:
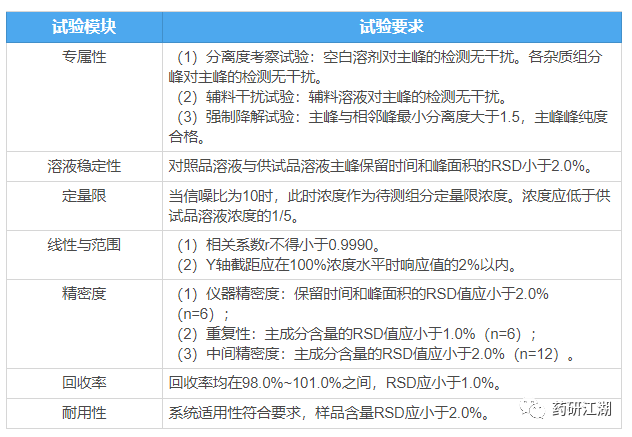
注:该表格为常规实验概述,特殊情况请自行增减内容。
下面分模块讲解各项试验内容:
1.1分离度考察试验
目的:考察空白溶剂、空白辅料和各杂质与待测组分峰之间的分离情况。空白溶剂、对照品溶液、供试品溶液:按拟定标准配制。空白辅料溶液:空白辅料按处方比例混合后,按拟定标准配制。各已知杂质定位溶液:没有明确规定,在配制浓度下杂质峰可见即可。勿配太大或太小,太大峰型过宽,不利于定位保留时间;太小在量程下看不到杂质峰,无法归属。有时可配制杂质混合溶液,用来排除杂质干扰。再配制加入主成分(主成分待测浓度)和各杂质的混合溶液,确定主成分与相邻杂质的分离度——两针搞定,无需进针分析各杂质定位溶液。
1.2强制降解试验
目的:考察降解生成的杂质与主成分峰之间的分离情况,同时可以大致了解样品在各降解条件下的稳定性情况。对于含量测定的强制降解试验,我们一般不需要知道降解所产生的杂质究竟是谁,只要确定降解杂质不影响主成分的测定即可。同样的,主峰峰纯度也是要关注的。看主峰中是否包含其他组分峰。降解试验条件要适度,降解程度尽量不低于80%,若条件足够剧烈,供试品仍未降解产生杂质,无需再提高降解条件的剧烈程度进行重复试验。注意:若分析方法为等度洗脱,降解试验的采集时间应适当延长,避免降解产生的杂质未洗脱出来而影响下一针分析。

目的:考察对照品溶液和供试品溶液配制后的稳定时间,为工艺验证、批检验、稳定性考察以及上市后的含量测定提供依据。系统适用性溶液视情况考察,对照品溶液与供试品溶液必须考察。应先考察室温下的溶液稳定性,若不稳定,则应逐一排除,找出不稳定的原因(光、热、析出等原因),然后再重复考察避光条件或冷藏条件下是否稳定。若仍然不稳定,可考虑更换溶剂、更换流动相系统等方法。如无法解决样品不稳定的问题,则质量标准需规定供试品临用现配。
注意:溶液稳定性的考察时间也应针对具体情况,如采集时间较长,考察时间也应延长,目的是使后续检验更方便。
目的:为确保分析方法测定供试品含量的灵敏度。定量限的概念:是指样品中被测物能被定量测定的最低量,其测定结果应具有一定的准确度。定量限体现了分析方法是否具备灵敏的定量检测能力。将对照品溶液逐级稀释,当稀释至信噪比约为10时,此时浓度可作为定量限浓度。含量测定并不强制要求做检测限。
注意:定量限结果受色谱系统影响较大,如色谱柱、流动相、色谱仪的状态,甚至次日试验的结果会与前一天不同,在这种情况下,若定量限浓度较低,应换用色谱系统再次测定,以确保方法的灵敏度。
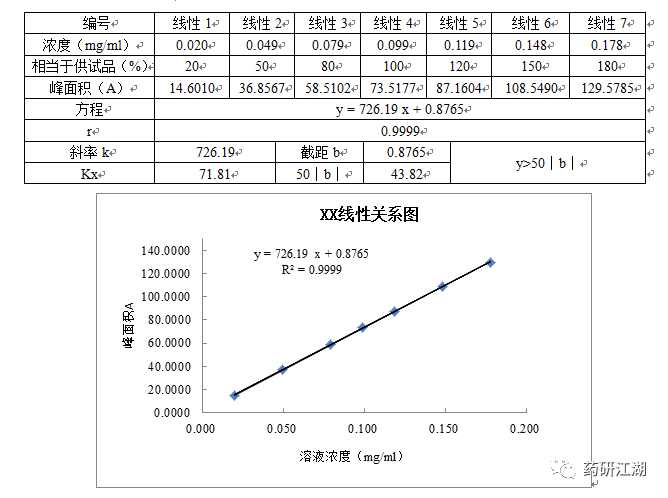
目的:在规定的浓度范围内,测定响应值(峰面积)与待测组分浓度呈比例关系的程度。敲黑板——峰面积与浓度呈线性关系,是外标法的前提。配制一份对照品母液,从中稀释配制成一系列不同浓度的线性溶液,至少制备5份(建议浓度点的总数为奇数),以测得的响应信号对待测物的浓度作图,检查是否呈良好的线性关系。含量测定线性范围应至少为80%~120%或更宽,含量均匀度线性范围应至少为70%~130%或更宽,线性的浓度范围理应涵盖回收率考察的浓度范围,但注意浓度最低点应高于定量限浓度。附一张推荐的数据结果表格与线性关系图如下:
5.1仪器精密度
目的:为保证仪器每次所测对照品溶液峰面积均一致,以确保含量测定结果的准确性,设计仪器精密度试验。取对照品溶液,连续进样6次。考察保留时间和峰面积的RSD%。
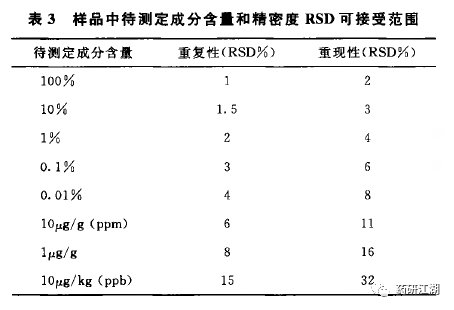
5.2重复性
目的:考察六次取样测定所得结果之间的接近程度。按照拟定标准配制空白溶剂、对照品溶液和6份供试品溶液(系统适用性溶液视情况配制),计算6份供试品溶液的含量,计算平均值并统计6份结果的RSD值。2015年版中国药典关于重复性的可接受范围截图如下:
5.3中间精密度
目的:考察在同一实验室,不同时间,由不同人员用不同设备测定结果之间的接近程度。溶液配制与实验要求同重复性。
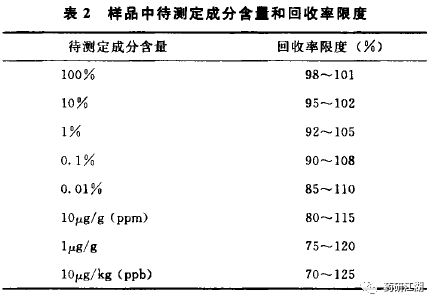
目的:考察采用拟定方法测定结果与真实值或参考值接近的程度,也叫做回收率试验。用至少测定6份结果进行评价,或设计3种不同浓度,每个浓度平行配制3份。按照拟定质量标准配制空白溶剂、对照品溶液。回收率供试品溶液:按处方比例混合的空白辅料+主成分对照品,再按照拟定质量标准配制溶液。仅做含量测定,推荐浓度为80%、100%、120%。做含量均匀度,推荐浓度为70%、100%、130%。2015年版中国药典关于回收率的可接受范围截图如下:
目的:考察色谱条件发生微小变化时对含量测定结果的影响。按照拟定标准配制空白溶剂、对照品溶液和供试品溶液(系统适用性溶液视情况配制),计算不同条件下供试品的含量测定结果,关注系统适用性是否符合标准要求(有时含量测定的方法中并不拟定配制系统适用性溶液,而是规定主峰理论板数和拖尾因子等,也要相应关注和统计。)。同样放一张表格,将耐用性试验内容和结果要求直观呈现如下:
耐用性考察的内容可能还有很多,请各位根据实际情况增减。另外,有时几个条件同时变化的情况下是否耐用,也是需要考察的。但考察叠加条件工作量较大,可自行选择较为重要的条件进行考察。耐用性试验时,观察峰型和结果的变化趋势,后续检验一旦出现问题,可以通过现象推测偏差原因,及时解决问题。
注意:变化不同色谱条件时,切记根据需要延长采集时间。
做完以上这些内容,各项结果均合格,就可以皆大欢喜去转移方法了。如果哪一项出现问题,建议先进行复测(必要时,换人换仪器进行复测),先找出问题所在,再行调整方法。
1.目前药品研发企业对时间的观念可谓超强,申报时间延误不得,在这种大环境下,合理安排实验时间至关重要。每天实验之前多想想,是否有多个实验的对照品溶液是可共用的,是否有多个实验是可以同时开展进行的。统筹规划,可以为你节省很多时间和精力,以及,买对照品的钱。
2.有时容易被忽略掉的,是中间产品的含量测定方法。我们通常习惯于直接采用成品的含量测定方法进行中间产品的控制,然而总混颗粒跟片剂的性质仍然有差异,有时会出现方法并不适用的情况,比如中间产品重复性不好,比如研磨时出现吸附现象,比如有时成品含量测定称样量较大而中间产品则可相应减小称样量。在方法验证前期注意到这些细节,及时进行考察,避免测定时才发现问题,会更加被动。
写在结尾的话
形成一个优秀的含量测定方法,为提高产品的质量保驾护航——这是对发你工资的药业应尽的责任,也是对整个药品研发行业的责任感。我们是小螺丝钉,是一块砖,也是行业潮流中一朵不可或缺的浪。
最后愿你试验顺利,少走偏差——致每一个,研发人。
声明:药研江湖对所有公众号产生内容保持严谨、中立的态度。文章仅供交流学习使用。如遇到内容有误,请与我们联系进行讨论和修改。(010-65104668)








