前 言
参比制剂( reference listed drug,RLD) 是用于仿制药质量和疗效一致性评价的对照药品。根据相关指南,是在欧盟、美国、日本获准上市并获得参比制剂地位的药品,也是我国仿制药参比制剂目录的重要来源。基于各种法规因素和商业因素,参比制剂的信息可能发生变化。本文以源自美国橙皮书的盐酸替扎尼定片4 mg( 商品名: Zanaflex) 为例,结合橙皮书目录、国家药品编码( national drug code,NDC) 目录、“Drugs@ FDA: FDA 批准的药品数据库”和DailyMed 产品标签库的支持数据,详细解析了其持证商( marketing authorizationholder,MAH) 信息变更的情况。在仿制药的研究开发和技术审评过程中,当参比制剂信息与官方公布信息有偏差时,本文内容可供参考。同时,建议对仿制药参比制剂目录进行动态管理、及时更新,促进一致性评价工作的顺利开展。
开展仿制药质量和疗效研究,首先必须明确参比制剂( reference listed drug,RLD) 。在我国参比制剂是指用于仿制药质量和疗效一致性评价的对照药品,通常为被仿制的对象。截至2018 年12 月29日,我国已发布了23批仿制药参比制剂目录。除部分已在国内上市的原研药品之外,美国橙皮书和日本橙皮书( 医疗用医药品品质情报集) 收录的参比制剂,以及欧盟上市的参比制剂,均为我国仿制药参比制剂目录的重要来源。已发布的参比制剂目录明确了仿制药研究的目标和方向,加快了一致性评价的进程。然而,已上市药品的信息并不是一成不变的。从药品全生命周期管理的角度来讲,上市后的药品可能会经历生产
提示:关注公众号:药研江湖,后台回复"参比制剂",获取药研江湖整理好的Excel版参比制剂目录电子版(1-24批)。
工艺、原辅料、质量标准乃至生产场地的变化; 同时,各种商业运作行为,如不同的企业之间的合并,收购和协作开发等,也可以对参比制剂的信息变化产生影响。对于源自国内上市原研药品的参比制剂而言,这些变化信息应由相关企业通过补充申请递交。但是对于源自欧盟、美国或日本的参比制剂,相关的信息可能就不在可控的范围之内。本文以源自美国橙皮书的盐酸替扎尼定片4 mg( 商品名: Zanaflex)为例,详细解析了其参比制剂信息变更的情况。
2.1 美国橙皮书
盐酸替扎尼定片4 mg 参比制剂盐酸替扎尼定片4 mg 收录于2017 年7 月21 日发布的仿制药参比制剂目录( 第八批),商品名为"Zanaflex",持证商为"Acorda Therapeutics Inc.",来源为美国橙皮书。2017 年美国的橙皮书为第37 版,经查询确认以上信息与该版橙皮书一致,见表1。
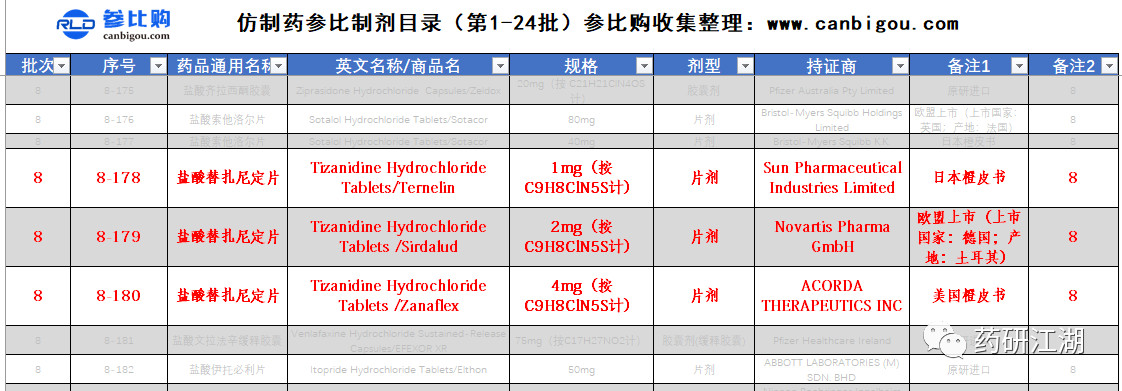
表1 盐酸替扎尼定片参比制剂信息
2.2 NDC与DailyMed
相关法规基础根据美国联邦食品、药品和化妆品法案( the federal food,drug,and cosmetic act,FD&C Act)第510节和美国联邦法规( code offederal regulations,CFR) 标题21: 食品与药品( title21: food and drugs) 项下§ 207 部分的要求,所有注册的药品企业,无论国内还是国外,应当通过电子递交的方式向FDA 提供现行的药品信息。依据这些递交信息的特点,分别在国家药品编码( nationaldrug code,NDC) 目录、FDA 标签库和每日医疗( DailyMed)中公开,以便于公众、医疗专业人员和制药行业人员查询。这些数据也为FDA 行使多项关键职能,如监管批准上市后的药品、潜在用户费用评估、生产现场检查、监控上市药品的短缺和可及性以及确定销售的药品是否经过审批等,提供了基本的依据。排版:药研江湖
提示:国家药品编码( NDC) 查询地址:https://www.accessdata.fda.gov/scripts/cder/ndc/index.cfmFDA
标签库和每日医疗( DailyMed)查询地址:https://dailymed.nlm.nih.gov/dailymed/index.cfm
2.3 Drugs@FDA
FDA 批准的药品数据库( Drugs@FDA)Drugs@ FDA[12]药品数据库收录了自1939 年以来FDA 批准上市的大部分药品,并且可以查询1998年以来批准上市药品的具体数据,如包装说明书、标签、批准信、审评内容和其他信息等。
美国橙皮书收录了FDA 根据FD&C Act 确定了安全和有效性而批准上市的药物产品,纸质版一般1 年发布1 次,此后以月为基础发布变更的信息,并逐月累积。如上所述,我国仿制药参比制剂目录( 第八批)中盐酸替扎尼定片4 mg 参比制剂的信息源自2017 年的第37 版。然而,以商品名"Zanaflex"为关键词在第38 版橙皮书中进行查询,我们发现该品种的持证商已经是"Covis PharmaBv",其新药上市申请( new drug applications,NDA)号为“NDA020397”。基于以上信息,初步判断该参比制剂的持证商发生了变化。
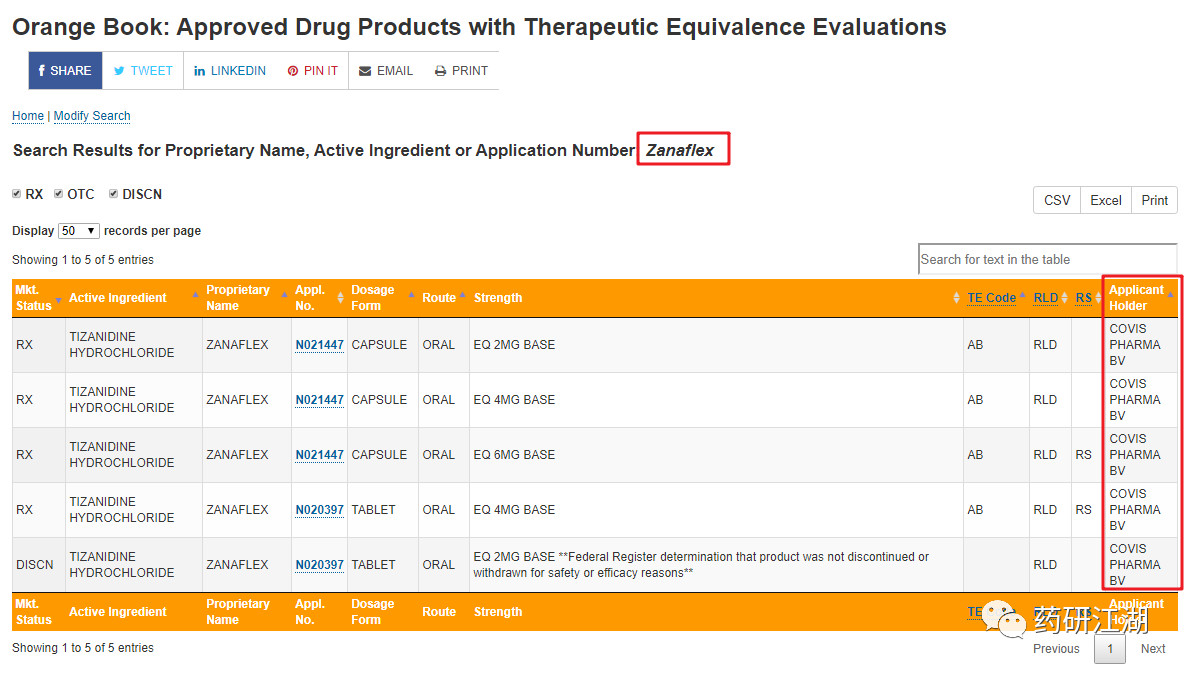
美国橙皮书查询结果
3.1 Drugs@FDA
Drugs@FDA 确认以"NDA020397"为关键词在"Drugs@ FDA: FDA 批准的药品数据库"中检索,确认该品种的持证商为"Covis Pharma Bv"。
3.2 NDC目录检索
NDC目录检索在美国NDC是每个药品都有的独特的三段式的数字形式编号,用作该药品的通用标识号。NDC 号一般由10 位数字构成,用以标明该产品的厂商号( labeler code ) 、产品号( product code) 和包装号( package code) 。
相关阅读:调研实战丨五分钟读懂美国药品的"身份证"—NDC号
如上所述,FDA 对企业所递交药品清单中的NDC 及相关信息进行整理和筛选,形成NDC 目录。以"NDA020397"为关键词在NDC 目录中检索,可知目前市场上在售的该参比制剂主要有4 种,见下图。
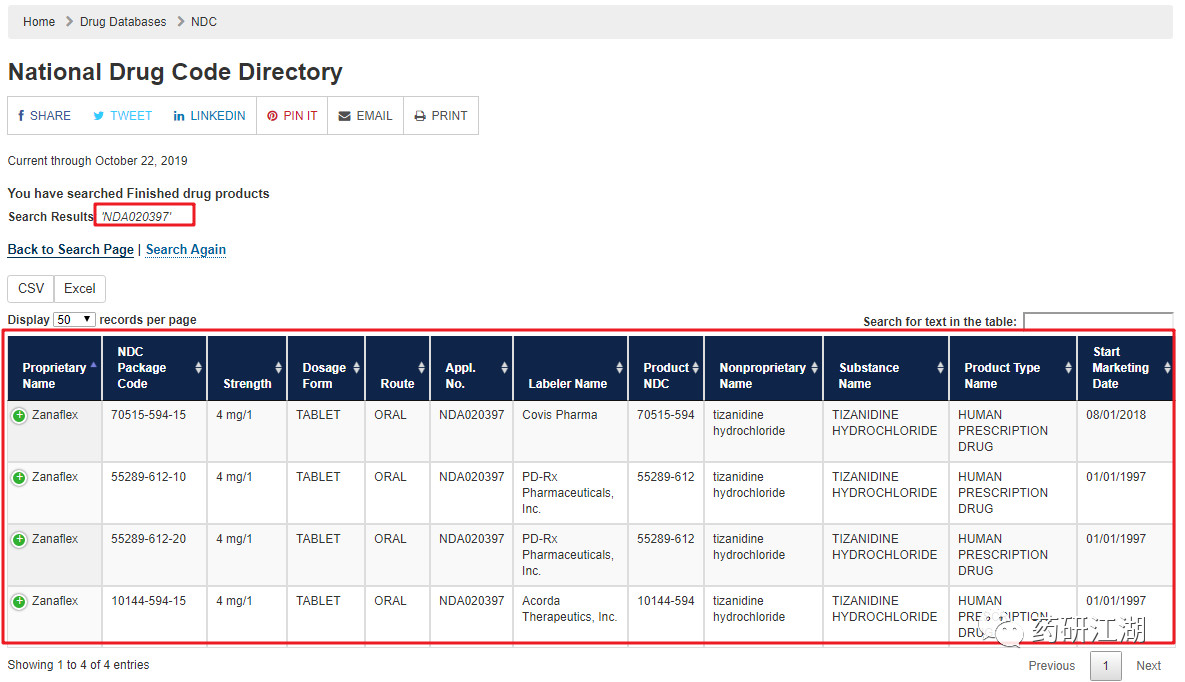
PS: 国家药品编码( NDC) 查询地址https://www.accessdata.fda.gov/scripts/cder/ndc/index.cfm
由上图可知,"Acorda Therapeutics,Inc."生产的盐酸替扎尼定片( Zanaflex) 4 mg 参比制剂将于2020年9 月30 日前终止上市。
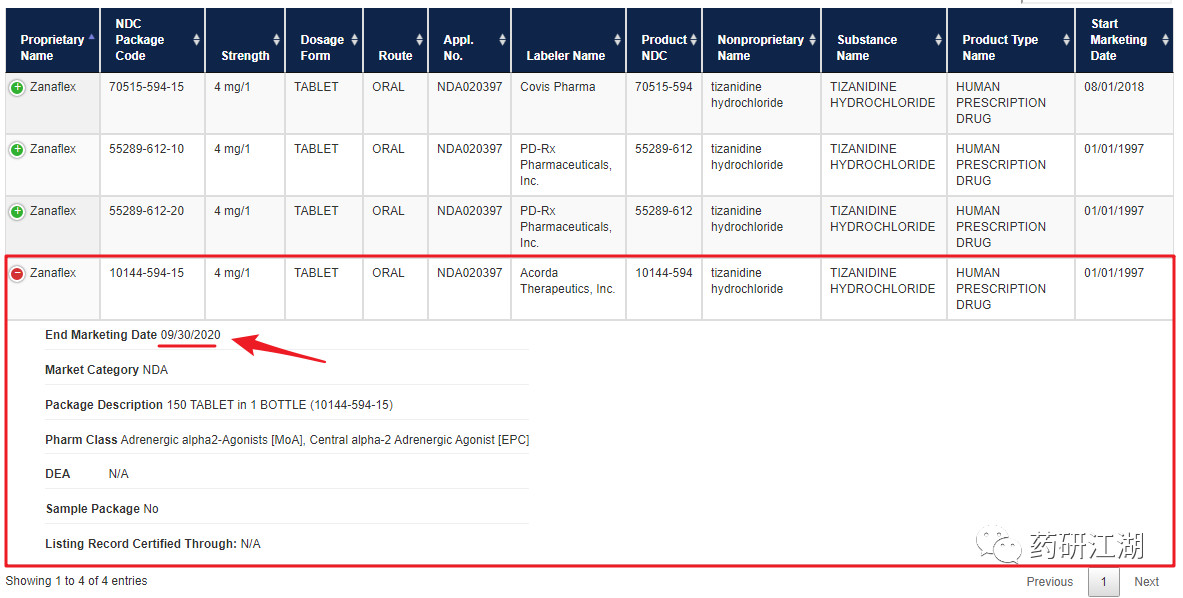
而"PD-Rx Pharmaceuticals,Inc."生产的2 种盐酸替扎尼定片( Zanaflex) 4 mg 参比制剂均为"Acorda Therapeutics,Inc."的重包装产品。

PS:这里可以从NDC号入手通过查询DailyMed 产品标签库,可以看到如下的标签图
虽然终止上市时间目前未知,但是由于"Acorda Therapeutics,Inc."的产品已不再供应,因此也应该在2020 年9 月30日前终止上市。所以,2020 年9 月30 日后,美国市场上盐酸替扎尼定片( Zanaflex) 4 mg 参比制剂主要由"Covis Pharma Bv"供应。检索中国上市药品目录集数据库可知,我国目前尚无盐酸替扎尼定片4 mg 通过仿制药质量和疗效一致性评价。对于准备后续开展该品种一致性评价研究的企业,就需要充分考虑参比制剂的市场可及性。
3.3DailyMed 产品标签结果判定
DailyMed 产品标签库检索分别以表2 中的NDC 号"70515-594-15"和"10144-594-15"为关键词,在DailyMed 的产品标签库进行检索,可以得到"Covis Pharma Bv"和"Acorda Therapeutics,Inc."所生产盐酸替扎尼定片( Zanaflex) 4 mg 参比制剂的包装,如下两个图。

图 "Covis Pharma Bv" 盐酸替扎尼定片4 mg 包装

图 "Acorda Therapeutics,Inc." 盐酸替扎尼定片包装
对比2 家企业的包装,可以发现除了企业名称和NDC 号发生变化外,其他内容和形式基本一致。企业网站信息查询表明,2家企业为业务发展伙伴关系。

来源:https://www.covispharma.com/
4.1 参比信息会动态变化
本文以源自美国橙皮书的盐酸替扎尼定片4 mg( 商品名: Zanaflex) 的持证商变更为例,详细解析了该变更在FDA 的监管状态。通过本文示例可知,基于各种法规因素和商业因素,参比制剂的信息不是一成不变的,FDA 对参比制剂进行动态管理。而我国仿制药参比制剂目录的内容发布以后,缺乏跟踪各参比制剂源数据变化的明确措施。因此,建议相关监管机构能够建立有效机制,对于源自国外上市药品的参比制剂信息,进行动态管理,及时更新,促进一致性评价工作的顺利开展。排版:药研江湖
4.2参考意义
在仿制药的研究开发和技术审评过程中,也会遇到所选择参比制剂信息与官方公布信息有偏差的情况。为了调查和研究出现偏差的原因,本文的示例提供了相应的方法和途径,可以供制药企业和技术审评人员参考。如果调查结果表明这些偏差并不影响产品的质量,并且符合参比制剂的相关规定,建议继续用于制药质量和疗效一致性评价,从而可以节约宝贵的研发时间和审评时间。
作者:杨东升,马玲云,南楠,牛剑钊,许鸣镝
单位:中国食品药品检定研究院,北京100050
排版:药研江湖
声明:药研江湖对所有公众号产生内容保持严谨、中立的态度。文章仅供交流学习使用。如遇到内容有误,请与我们联系进行讨论和修改。(010-65104668)








