对于药品质量标准的内容,从事分析工作的同学再熟悉不过,性状、鉴别、检查、含量测定。
其中检查项基本可分为安全性检查和有效性检查。
有效性检查项目包括大家熟知的装量差异、溶出度、含量均匀度、可见异物、不溶性微粒、水分、有关物质等等......
微生物限度检查和无菌检查则属于安全性检查的部分。
安全性检查是比有效性检查的项目更加需要关注和严格制定的。

今天小编就带大家重点学习微生物限度检查和无菌检查。
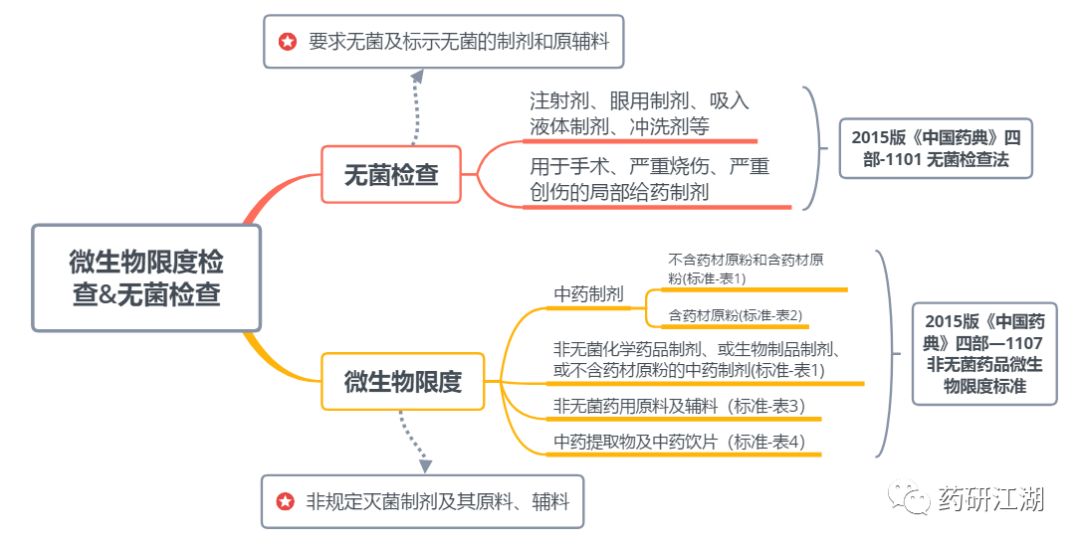
1.什么情况下质量标准中该制定微生物限度?
2.什么情况下该制定无菌检查?
3.限度又该如何确定?
这是2015年版《中国药典》二部下的甲状腺片的质量标准,微生物限度内容是否了解呢?

这是2015年版《中国药典》二部下注射用甲氨蝶呤的质量标准,无菌检查项是否能看懂呢?

下面咱们详细了解微生物限度检查和无菌检查。
药典中常见的格式:
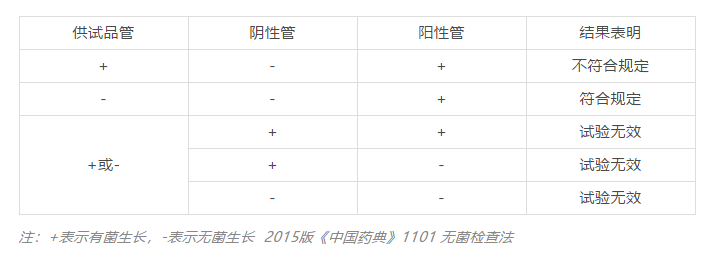
无菌 取本品,经薄膜过滤法处理,依法检查(通则1101),应符合规定。

无菌检查法系用于检查药典要求无菌的药品、生物制品、医疗器具、原料、辅料及其他品种是否无菌的一种方法。
1、制剂通则或品种项下要求无菌及标示无菌的制剂和原辅料应制定无菌限度。包括注射剂、眼用制剂、吸入液体制剂、冲洗剂等。
2、用于手术、严重烧伤、严重创伤的局部给药制剂。
无菌检查法包括薄膜过滤法和直接接种法。只要供试品性质允许,应采用薄膜过滤法。
薄膜过滤法一般应采用封闭式薄膜过滤器。无菌检查用的滤膜孔径应不大于0.45微米 ,直径约为50mm。根据供试品及其溶剂的特性选择滤膜材质。使用时,应保证滤膜在过滤前后的完整性。
直接接种法适用于无法用薄膜过滤法进行无菌检查的供试品,即取规定量供试品分别等量接种至硫乙醇酸盐流体培养基和胰酪大豆胨液体培养基中。
药典中常见的格式:
微生物限度 取本品,照非无菌产品微生物限度检查:微生物计数法(通则1105)和控制菌检查法(通则1106)及非无菌药品微生物限度标准(通则1107)检查,应符合规定。
微生物限度检查法系检查非规定灭菌制剂及其原料、辅料受微生物污染程度的方法。
检查项目包括需氧菌总数、霉菌和酵母菌总数及控制菌检查。
微生物计数法:用于能在有氧条件下生长的嗜温细菌和真菌的计数。
控制菌检查法:用于在规定的试验条件下,检查供试品中是否存在特定的微生物。
微生物计数法的供试品检查包括三种方法:平皿法、薄膜过滤法、MPN法,都是根据计数方法适用性试验确定的。

控制菌检查根据药物剂型的不同,包括大肠埃希菌、耐胆盐革兰氏阴性菌、沙门菌、铜绿假单胞菌、金黄色葡萄球菌、梭菌、白色念珠菌。
需氧菌总数指TSA培养基上生长的总菌落数,霉菌和酵母菌总数指SDA培养基上生长的总菌落数。
控制菌检查则以阳性对照试验检出相应控制菌、阴性对照试验无菌生长下,供试品检查的结果为准。
微生物限度的制定,根据制剂、原料、中药提取物的不同,标准会有不同:
# 第一种情况
如果制剂是非无菌化学药品制剂、或生物制品制剂、或不含药材原粉的中药制剂,请看表1的限度标准。
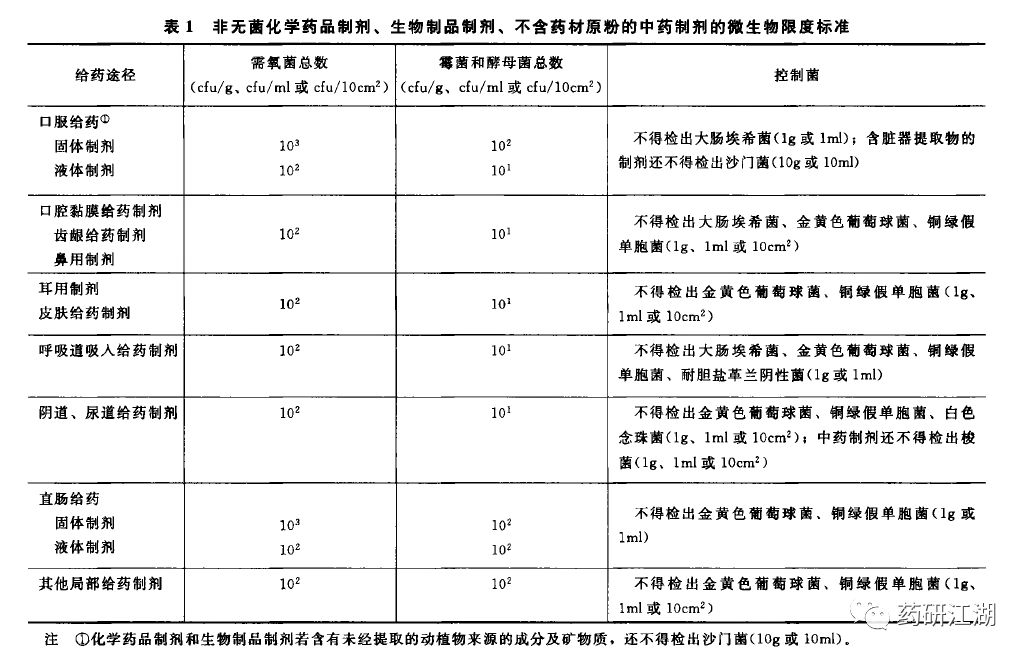
2015版《中国药典》四部—1107 非无菌药品微生物限度标准
举个例子,如阿司匹林肠溶片。

首先,判断其分类属于口服给药的固体制剂。
其次,在上表中找到其所属分类(第一列第二行)。
则其应遵守的限度标准如下:
需氧菌总数的限度应是10^3,即2000cfu/g;
霉菌和酵母菌总数的限度是10^2,即200cfu/g;
不得检出大肠埃希菌(1g或1ml),含脏器提取物的制剂还不得检出沙门菌(10g或10ml)。
标准的一些说明:
2015版《中国药典》四部通则1107中关于菌数标准的解释 。

根据药典中大肠埃希菌的检查方法,表1中的"控制菌"项下的要求才被规定为“不得检出大肠埃希菌(1g或1ml)”。

同理适用于沙门菌的检验,表1中的"控制菌"项下的要求规定为“含脏器提取物的制剂还不得检出沙门菌(10g或10ml)”。

# 第二种情况
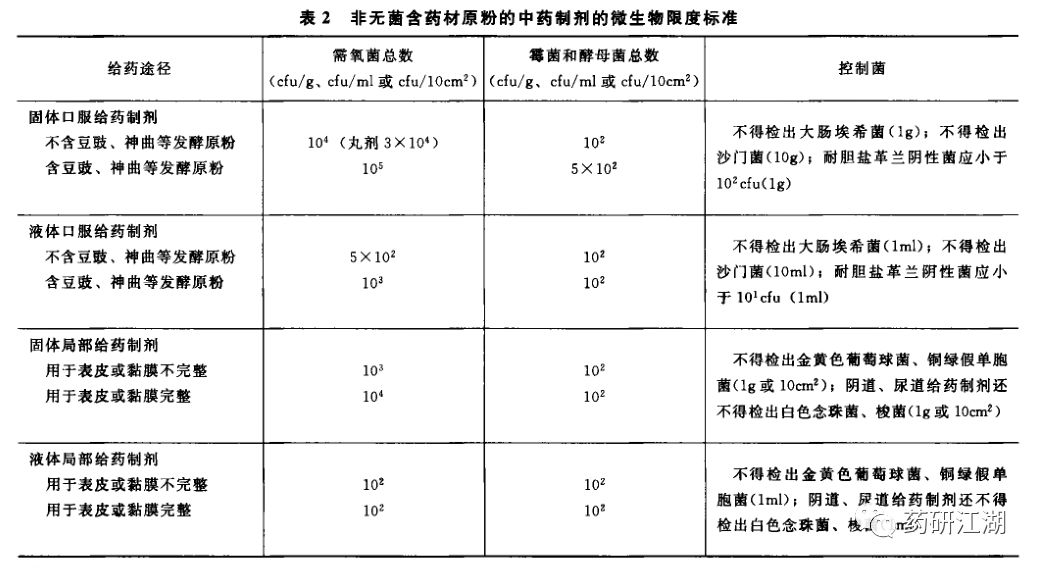
如果你做的是中药制剂,就分为两种情况:不含药材原粉和含药材原粉,不含药材原粉请看刚才说过的表1,含药材原粉请看下表2。
与表1相比,其控制的限度和控制菌检查项均有变化。
# 第三种情况
非无菌药用原料及辅料的微生物限度标准见表3

# 第四种情况
中药提取物及中药饮片的微生物限度标准见表4

看完上述讲解后,我们再看一遍开篇的示例,是不是能很好理解了?
随便选一个药品原料、辅料、制剂,该做无菌?该做微生物限度?做哪方面内容?各自限度是什么?都能回答出来了吧?
大家可以通过下图回顾本文内容:
此外,药典标准毕竟是最低标准,企业会根据自己产品的具体质量制定内控标准,会比药典更严格一些,但不管怎么制定,都是菌数缩小一些,内容还是上文所述这几项。
有的研究机构不具备做微生物限度检查和无菌检查的条件,会选择外包这部分实验,但是外包做的合不合格,自家产品的微生物方面的稳定性如何,看完这篇文章,外包甩回来微生物结果是不是能轻松接住了?
如仍有不清楚的问题,欢迎留言讨论。
声明:药研江湖对所有公众号产生内容保持严谨、中立的态度。文章仅供交流学习使用。如遇到内容有误,请与我们联系进行讨论和修改。(010-65104668)








